세포 외에서의 대사경로 재구성 및 이의 활용

충남대학교 김동명 교수
1. 개요
효소와 세포 등의 생촉매는 화학촉매에 비해 온화한 조건에서 높은 선택성으로 화학반응을 촉매하는 장점을 가지고 있다. 생촉매에 의해 진행되는 생물전환공정은 넓은 범위의 공정 복잡성과 산물 부가가치를 가진다. 단백질 의약, 항체, 광학이성질체, 택솔, 항생제 등은 kg 당 가격이 수천에서 수십억 달러에 이르는 반면, 에탄올, 수소, 젖산 등과 같은 제품들의 가격은 kg 수 달러 정도이다 (Lynd et al, 1999). 바이오 연료와 바이오 케미컬을 생산하기 위한 화이트 바이오텍 기술은 고가의 의약품을 생산하기 위한 레드 바이오텍 기술에 비해 경제적 동인, 원료의 가격, 공정비용, 자본투자규모 등에서 많은 차이점을 보인다. 즉, 단위 가격이 낮은 바이오커머더티 제품은 탄수화물 등의 원료물질이 차지하는 가격 비중이 30~70%에 이르는 반면, 바이오의약품의 경우 원료비용은 크게 고려되지 않는다 (Lynd et al.,1999).
생물전환기술은 반응 및 촉매의 복잡성에 따라 단일효소반응, 다효소반응, 무세포반응, 전세포반응의 네 가지로 구분될 수 있다. 단일효소 반응은 단순한 화학반응의 진행을 위해 사용될 수 있으며 현재 대략 4,800 여종의 효소가 브렌다 데이터베이스에 등록되어 있다 (Chang et al., 2009). 단일 효소 반응은 glucose isomerase를 이용한 과당의 생산, amidase를 이용한 베타락탐계 항생제의 생산 등과 같은 분야에서 산업적인 규모로 이용되고 있다 (Bhosale et al., 1996; Vasic-Racki, 2006). 비교적 복잡한 다단계 반응의 경우는 복수의 효소의 one-pot 반응을 이용할 수 있다 (Vasic-Racki, 2006). 예를 들어, endoglucanase, cellobiohydrolase, beta-glucosidase의 동시사용을 통한 셀룰로오스의 분해 (Zhang and Lynd, 2004), NAD(P)H 재생을 통한 광학이성질 알콜의 생산 (Hummel, 1999; Wichmann and Vasic-Racki, 2005), 고분자체의 생산 (Meyer et al., 2007; Shaeri et al., 2008) 등이 보고된 바 있다. 복수의 효소를 사용한 one pot 반응은 단위공정의 절감, 반응부피의 최소화, 높은 생산수율, 짧은 공정사이클, 폐기물의 최소화 등과 같은 장점을 가지고 있다. 또한 단위반응들의 결합을 통해 열역학적으로 불리한 반응의 산물을 가능하게 할 수도 있다 (Chi et al., 2008; Daines et al., 2004). 이미 수 천년전부터 자연상의 미생물이 사용하여 에탄올과 치즈생산 공정에 적용된 바와 같이, 복잡한 생전환 반응은 자연적인 혹은 유전적으로 조작된 생세포를 이용하여 시도될 수 있다. 유전자 조작기술의 발전에 힘입어 에탄올 (Shaw et al., 2008), 부탄올 (Atsumi et al., 2008), 지방산에스테르 (Kalscheuer et al., 2006), 수소 (Logan, 2004; Maeda et al., 2008) 등의 저가화학물질에서 항생제, 비타민, 백신, 효소, 항생제, 당화단백질, 라이코펜, 아르테미시닌, 택솔 등의 고가산물에 이르기까지 다양한 물질의 생산성 향상을 위한 미생물의 엔지니어링이 시도되어 왔다 (Chang and Keasling, 2006; Demain, 2000; Hamilton et al., 2003; Klein-Marcuschamer et al., 2007; Maynard and Georgiou, 2000; Zhong, 2001). 그러나, 전 세포 기반의 생물전환 공정은 세포의 엔지니어링을 위해 많은 시간과 노력이 요구되며 세포 성장과 유지를 위한 물질과 에너지의 소모, 산물 축적에 따른 세포독성 등의 한계를 가질 수 있다. 또한 세포 내에서의 대사산물 생산 시 대사과정의 각 단계의 효소들이 전사, mRNA 안정성, 번역단계의 조절을 받게 된다. 이 같은 문제점들은 세포의 대사과정에 작용하는 효소, 조효소, 작용물질들을 세포 외에서 재구성하여 인공적인 대사네트워크를 구성함으로써 극복 될 수 있을 것이다.
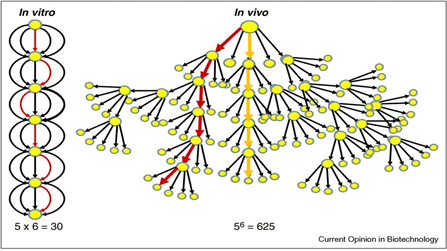
그림 1. in vitro 시스템과 in vivo 시스템의 상대적 복잡성 (출처: Curr Opin Biotechnol)
그림 1에서 보이는 바와 같이, 효소들의 재구성을 통한 목적 대사산물의 생산은 세포를 사용하는 경우에 비해 복잡성을 크게 줄일 수 있고, 세포 자체의 대사경로의 복잡성으로 인한 대사경로 변경의 어려움과 정량화, 수율의 한계 등의 문제점들을 감소시킬 수 있다. 예를 들어 그림에 보이는 바와 같이 비교적 단순한 6단계의 대사경로를 통한 산물의 생산의 경우, 생세포의 유전자 조작을 통한 대사경로의 변경 및 탐색을 위해서는 56 = 625가지에 이르는 조합이 테스트되어야 하는 반면 개별 효소의 조합을 통한 대사경로의 재구축을 위해서는 30가지의 조합만이 검증되면 된다.
다 종의 효소를 포함한 무세포 생물전환의 개념은 새로운 개념은 아니어서 노벨상 수상자인 Eduard Buchner는 이미 1897년에 효모세포의 파쇄액을 사용한 무세포 발효에 관한 결과를 발표한 바 있고, 단백질 합성을 위한 무세포 전환 시스템은 세포독성 등의 문제로 세포 내 발현이 어려운 재조합 단백질들의 생산을 중심으로 그 적용이 확대되어 가고 있다 (Boyer et al., 2008; Hirao et al., 2002; Noren et al., 1989).
Design, extraction, standardization의 공학적 원리를 생물시스템에 적용하고자 하는 합성생물학은 크게 in vivo 합성생물학과 in vitro 합성생물학으로 대별 될 수 있을 것이다 (Foster and Church, 2007; Meyer et al., 2007). 현재까지의 합성생물학 연구는 대부분 in vivo시스템을 중심으로 이루어져 왔으나, in vitro시스템을 적용한 합성생물학은 세포의 생존성 확보, 복잡성, 세포활성유지, 세포막의 존재등과 같은 제한요건으로부터 자유롭게 생물시스템을 설계하고 엔지니어링할 수 있다는 명확한 장점을 가지고 있다 (Benner and Sismour, 2005; Endy, 2005).
이 보고서에서는 대사경로의 세포 외 재구축을 통해 보다 다양한 유용 대사산물을 생산하고자 시도되고 있는 최근의 연구동향에 대하여 소고하고자 한다.
2. 바이오 연료
통상적으로 미생물의 발효를 통해 생산되는 에탄올은 효모의 세포 파쇄액을 통해서도 생산될 수 있음이 Buchner에 의해 입증된 바 있다 (Buchner, 1897). 그러나, 해당작용에서의 ATP의 축적은 가해진 포도당은 완전히 에탄올로 전환되지 못하게 된다 (Welch and Scopes, 1985).
C6H12O6(aq) + 2ADP +2Pi → 2C2H6O(aq) + 2CO2(g) + 2ATP
Welch and Scopes는 재구축된 효모의 해당대사경로에 ATPase를 첨가하여 지속적으로 ADP를 공급함으로써 180g/L의 포도당으로부터 90g/L의 에탄올을 생산하여 이론적 수율의 99%에 이르는 전환율을 달성할 수 있었다. 또한, ATPase대신 arsenate를 첨가함으로써도 유사한 수율의 전환율에 도달할 수 있음을 보였다 (Nelson and Cox, 2008). 이는 arsentate가 phosphate를 대신하여 ADP에 결합할 수 있지만 자연적으로 가수분해되는 성질을 이용한 것으로, 생물전환 대사경로와 비생물적 요소를 결합을 통한 공정의 최적화를 이룰 수 있는 것으로 보이는 예라고 할 수 있다. 생물학적 공정을 통해 생산될 수 있는 알코올의 또 다른 예로 부탄올을 들 수 있다. 에탄올에 비해 높은 에너지 밀도를 가지고 있으나 발효공정을 통해 에탄올과 같은 높은 농도로 생산될 수 없는 부탄올의 생산 (Lee et al., 2008)은 세포 외 대사경로 재구축을 통한 생산이 유용한 대안이 될 수 있는 산물이라 할 수 있다.
C6H12O6(aq) + 2ADP +2Pi → C4H10O(aq) + 2CO2(g) + 2ATP
3. 바이오 수소
탄소중립적인 수소가스는 미래의 수송용 연료로서 각광을 받고 있다. 수소가스는 화학공정, 바이오공정, 융합공정의 다양한 경로를 통해 바이오매스로부터 생산될 수 있으나 대부분의 현존 기술은 대부분 이론 수율인 12 H2/glucose에 한참 못 미치는 낮은 수율과 부산물의 생성 및 거친 반응조건의 한계를 가지고 있다 (Zhang, 2009). 그러나, 세포 외 대사경로의 재구축을 통해 포도당으로부터 거의 이론치에 이르는 수소의 생산이 가능함이 최근 Zhang등에 의해 입증된 바 있다. 특히 이들은 starch나 cellucose등의 바이오매스로부터 출발하여 one-pot반응에 의해 이러한 높은 수율을 달성할 수 있었다는 점이 주목할 만하다. 이들은 glucan phosphorylase에 의해 G1P를 생성하고, 이를 phosphoglucomutase에 의해 G6P로 전환한 후 10개의 효소를 사용하여 재구축한 pentose phosphate pathway를 통하여 12분자의 NADPH를 생성할 수 있도록 하였다. 생성된 NADPH는 hydrogenase에 의한 수소의 생산에 이용되었다.
C6H10O5(aq) + 7H2O(l) → 12H2(g) + 6CO2(g)
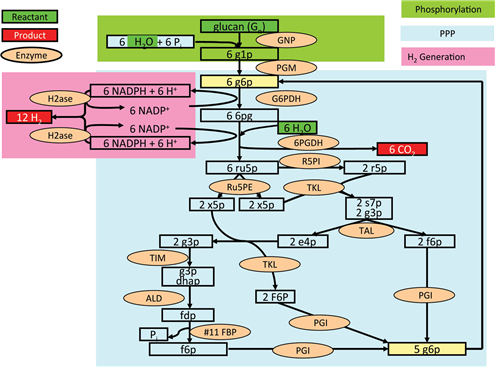
그림 2. 재구성된 대사경로를 통한 수소생산 (출처: Biotechnol Bioeng)
4. 바이오 전기
화학적 촉매를 사용하여 화학적 에너지를 전기에너지로 변환시키기 위한 연료전지는 최근 많은 발전을 이루어 왔고, 특히 효소를 이용한 생물학적 에너지전환에 대한 연구도 활발히 진행되고 있다 (Calabrese Barton et al., 2004; Cooney et al., 2008). 효소들은 당이나 알콜 혹은 유기산 등의 물질들을 산화 및 환원시키는 효소들을 음극과 양극에 고정화시켜 전기를 생성하는 효소연료전지들은 빠른 속도로 충전되고 높은 에너지 저장 밀도를 달성할 수 있으나, 현재까지 상업적인 효소 연료전지는 개발되어있지 않은데 이는 주로 효소의 낮은 안정성과 낮은 전압이라는 한계에 기인한다. 그러나, Sony를 비롯한 몇 몇 기업들은 꾸준히 효소 연료전지의 성능을 개선하기 위한 연구개발을 계속하고 있다 (Sakai et al., 2009). 당이나 여타의 유기물을 완전히 전기로 전기에너지로 변환할 수 있다면 높은 에너지 사용효율, 증가된 에너지 저장밀도, 효소저해의 감소, 높은 출력 등의 잇점을 가져올 수 있을 것이다 (Cooney et al., 2008; Minteer et al., 2007). 한편, 현재까지 개발된 대부분은 화학연료를 완전히 산화시키지 못하므로 연료물질에 포함된 에너지의 일부만을 전기에너지로 전환시킬 수 있을 뿐이다 (Bullen et al., 2006; Glykys and Banta, 2009; Ramanavicius et al, 2008; Sakai et al., 2009). 한편 최근 Sokic-Lazic과 Minteer는 NAD(P)H와 FADH2 을 생산하기 위한 6종의 효소와 5종의 보조효소를 사용하여 에탄올을 완전히 산화시킬 수 있는 citric acid cycle를 탄소전극에 고정화된 효소들을 사용하여 구현함으로써 alcohol dehydrogenase 한 종류의 효소만을 이용한 연료전지에 비해 power density를 8.71배로 획기적으로 증가시킬 수 있었다 (Sokic-Lazic and Minteer, 2008).
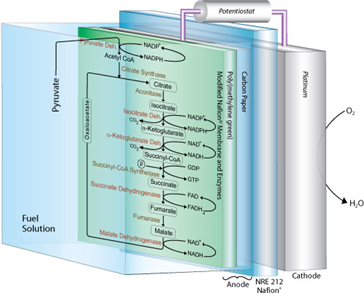
그림 3. Citric acid cycle의 재구성을 통한 효소연료전지의 개요 (출처: Curr Opin Biotechnol)
5. 고찰
산업적 전환공정을 설계에는 산물의 수율, 농도, 생산성 세 가지가 고려되어야 한다. 바이오커머더티의 생산에 있어서는 수율이 가장 중요하게 고려되는데 이것은 생산비용의 상당부분 (~30-70%)이 원료 즉 탄수화물의 가격에 기인하기 때문이다. 그 다음으로 고려되어야 하는 것은 산물의 농도로 이는 추후 산물의 분리정제 비용에 영향을 미치기 때문이다. 반면, 고부가가치 산물의 생산에 있어서는 일반적으로 분리정제 공정이 전체 비용에서 차지하는 비중이 80% 이상을 차지하게 되므로 반응액의 산물 농도가 최우선으로 고려되어야 하며 최종산물가격의 1% 이하를 차지하는 원료가격의 비중으로 인해 전환반응의 수율은 크게 고려되지 않는다. ~$0.18/kg ($10.6/GJ)정도인 바이오매스 탄수화물의 가격과 현재 $2/gallon ($22.1/GJ)정도인 에탄올의 가격을 기준으로 볼 때 경제적인 에탄올의 생산을 위해서는 최소 70-80%의 수율이 확보되어야 한다. 부탄올, FAME, 알칸류 등 다른 종류의 바이오 연료의 생산에 있어서도 원료탄수화물에 대한 바이오연료의 생산성은 이론 수율의 최소 70% 이상의 수율이 담보되어야 한다. 호기성 발효과정에서는 원료 탄수화물의 50-90%가 혐기성 발효에서는 ~10%정도가 세포의 성장을 위해 사용된다는 점을 고려할 때 세포배양공정을 통해 이론수율에 근접하는 산물생산수율을 획득하기 위해서는 균주의 선택과 공정의 설계에서 많은 부분들이 고려되어야 함을 알 수 있다. 에탄올 발효는 현재까지 개발된 공정 중에서 가장 높은 수율을 달성한 공정으로 이론 수율의 90-95%에 이르는 수율로 생산되고 있다. 그러나, 부탄올의 경우는 산물의 저해작용 등의 이유로 인해 90% 수율에 도달하기가 힘든 실정이다.
이에 비해, 세포 외에서 재구축된 합성 대사네크워크는 기질과 산물의 전달을 저해하는 세포막의 부재, 기질 전달을 위한 에너지사용 불필요, 다량의 효소사용 가능 등의 잇점으로 인해 세포기반의 전환반응에 비해 높은 수율과 생산성 도달을 가능하게 할 수 있다. 최근의 보고에 따르면 재조합 효소를 사용한 대사경로의 재구축을 통해 바이오수소의 생산을 20배 이상 증가시킬 수 있었으며 사용되는 효소량의 증가, 고온공정의 적용, 기질농도의 증가, 대사중간물의 채널링 등의 방법을 통해 그 생산성을 더욱 향상시킬 수 있을 것으로 기대된다.
알코올과 유기산 등과 같은 대사산물은 종종 미생물 발효공정의 제한요소로 작용하게 된다. 이들 산물에 의한 세포의 저해는 대부분 이들로 인한 세포막의 파괴에 기인하게 되며 실제 전환반응에 참여하는 효소들은 산물에 의한 저해를 심하게 받지 않는 것이 일반적이다. 즉, 효소들은 세포막에 비하여 더 높은 산물저항성을 가지며 예를 들어, 곰팡이 유래의 cellulase들은 200g/L의 에탄올 혹은 100g/L의 부탄올 존재 시에도 약 20% 정도의 활성 감소만을 보이는 것으로 알려져 있다. 더욱이 효소들의 유기용매에 대한 저항성은 단백질 공학기법을 통하여 더욱 향상시킬 수 있으므로 세포를 사용한 생물전환에 비해 고농도의 산물을 저해작용 없이 생산할 수 있을 것이다.
효소를 사용한 대사경로의 재구축은 완전히 새로운 개념은 아니다. 그러나, 이를 통한 바이오산물의 생산은 ATP 및 NAD(P)H의 밸런스를 포함한 정교한 대사경로의 설계, 효소의 개량 및 안정화, 경제적인 조효소의 재사용 등의 망라를 요구하는 새로운 기술로 부각되고 있다. 세포외에서 재구축된 대사경로를 통하여 목적산물들을 대량생산하기 위해서는 두 가지 기술적 요인들이 해결되어져야 한다. 우선, 표준화된 부품으로서의 효소들의 안정화 기술이 확보되어야 한다. 스마트폰, 디지털 카메라 등의 예에서 보이는 바와 같이 안정적으로 기능할 수 있는 표준화된 효소부품들은 유용화학물질의 생산을 위해 장시간 작동될 수 있는 인공적인 대사경로의 구축을 용이하게 할 수 있을 것이다. 또한, kinetic modeling, metabolite flux analysis, metabolic control analysis등의 다양한 기법의 적용을 통해 생산성을 향상시킬 수 있는 플랫폼이 구축되어져야 할 것이다.
6. 참고문헌
1. Atsumi S, Hanai T, Liao JC. 2008. Non-fermentative pathways for synthesis of branched-chain higher alcohols as biofuels. Nature 451(7174):86–89.
2. Benner SA, Sismour AM. 2005. Synthetic biology. Nat Rev Genet 6(7):533–543.
3. Bhosale S, Rao M, Deshpande V. 1996. Molecular and industrial aspects of glucose isomerase. Microbiol Rev 60(2):280–300.
4. Boyer ME, Stapleton JA, Kuchenreuther JM, Wang C-W, Swartz JR. 2008. Cell-free synthesis and maturation of [FeFe] hydrogenases. Biotechnol Bioeng 99(1):59–67.
5. Buchner E: Alkoholische Gahrung ohne Hefezellen (Vorlaufige Mittheilung). Ber Chem Ges 1897, 30:117-124.
6. Bullen RA, Arnot TC, Lakeman JB, Walsh FC. 2006. Biofuel cells and their development. Biosens Bioelectron 21(11):2015–2045.
7. Calabrese Barton S, Gallaway J, Atanassov P. 2004. Enzymatic biofuel bells for implantable and microscale devices. Chem Rev 104(10):4867–4886.
8. Chang A, Scheer M, Grote A, Schomburg I, Schomburg D. 2009. BRENDA, AMENDA and FRENDA the enzyme information system: New content and tools in 2009. Nucleic Acids Res 37(Suppl 1):D588–D592.
9. Chang MCY, Keasling JD. 2006. Production of isoprenoid pharmaceuticals by engineered microbes. Nat Chem Biol 2(12):674–681.
10. Chaudhuri SK, Lovley DR. 2003. Electricity generation by direct oxidation of glucose in mediatorless microbial fuel cells. Nat Biotechnol 21(10):1229–1232.
11. Chi Y, Scroggins ST, Frechet JMJ. 2008. One-pot multi-component asymmetric cascade reactions catalyzed by soluble star polymers with highly branched non-interpenetrating catalytic cores. J Am Chem Soc 130(20):6322–6323.
12. Cooney MJ, Svoboda V, Lau C, Martin G, Minteer SD. 2008. Enzyme catalysed biofuel cells. Energy Environ Sci 1:320–337.
13. Daines AM, Maltman BA, Flitsch SL. 2004. Synthesis and modifications of carbohydrates, using biotransformations. Curr Opin Chem Biol 8:106–113.
14. Demain AL. 2000. Small bugs, big business: The economic power of the microbe. Biotechnol Adv 18(6):499–514.
15. Forster AC, Church GM. 2007. Synthetic biology projects in vitro. Genome Res 17(1):1–6.
16. Glykys DJ, Banta S. 2009. Metabolic control analysis of an enzymatic biofuel cell. Biotechnol Bioeng 102(6):1624–1635.
17. Hamilton SR, Bobrowicz P, Bobrowicz B, Davidson RC, Li H, Mitchell T, Nett JH, Rausch S, Stadheim TA, Wischnewski H, Wildt S, Gerngross TU. 2003. Production of complex human glycoproteins in yeast. Science 301(5637):1244–1246.
18. Hirao I, Ohtsuki T, Fujiwara T, Mitsui T, Yokogawa T, Okuni T, Nakayama H, Takio K, Yabuki T, Kigawa T, Kodama K, Yokogawa T, Nishikawa K, Yokoyama S. 2002. An unnatural base pair for incorporating amino acid analogs into proteins. Nat Biotechnol 20(2):177–182.
19. Hummel W. 1999. Large-scale applications of NAD(P)-dependent oxidoreductases: Recent developments. Trends Biotechnol 17(12):487–492.
20. Kalscheuer R, Stolting T, Steinbuchel A. 2006. Microdiesel: Escherichia coli engineered for fuel production. Microbiology 152(9):2529–2536.
21. Klein-Marcuschamer D, Ajikumar PK, Stephanopoulos G. 2007. Engineering microbial cell factories for biosynthesis of isoprenoid molecules: Beyond lycopene. Trends Biotechnol 25(9):417–424.
22. Maeda T, Sanchez-Torres V, Wood TK. 2008. Metabolic engineering to enhance bacterial hydrogen production. Microb Biotechnol 1(1):30–39.
23. Maynard J, Georgiou G. 2000. Antibody engineering. Annu Rev Biomed Eng 2(1):339.
24. Meyer A, Pellaux R, Panke S. 2007. Bioengineering novel in vitro metabolic pathways using synthetic biology. Curr Opin Microbiol 10:246–253.
25. Logan BE. 2004. Extracting hydrogen and electricity from renewable resources. Environ Sci Technol 38:160A–167A.
26. Logan BE, Regan J. 2006. Electricity-producing bacterial communities in microbial fuel cells. Trends Microbiol 14(12):512–518.
27. Lynd LR, Wyman CE, Gerngross TU. 1999. Biocommodity engineering. Biotechnol Prog 15:777–793.
28. Nelson DL, Cox MM: Lehninger Principles of Biochemistry (5th edition). New York: WH Freeman; 2008.
29. Noren CJ, Anthony-Cahill SJ, Griffith MC, Schultz PG. 1989. A general method for site-specific incorporation of unnatural amino acids into proteins. Science 244(4901):182–188.
30. Ramanavicius A, Kausaite A, Ramanaviciene A. 2008. Enzymatic biofuel cell based on anode and cathode powered by ethanol. Biosens Bioelectron 24(4):761–766.
31. Sakai H, Nakagawa T, Tokita Y, Hatazawa T, Ikeda T, Tsujimura S, Kano K. 2009. A high-power glucose/oxygen biofuel cell operating under quiescent conditions. Energy Environ Sci 2:133–138.
32. Shaeri J, Wright I, Rathbone EB, Wohlgemuth R, Woodley JM. 2008. Characterization of enzymatic D-xylulose 5-phosphate synthesis. Biotechnol Bioeng 101(4):761–767.
33. Shaw AJ, Podkaminer KK, Desai SG, Bardsley JS, Rogers SR, Thorne PG, Hogsett DA, Lynd LR. 2008. Metabolic engineering of a thermophilic bacterium to produce ethanol at high yield. Proc Natl Acad Sci USA 105:13769–13774.
34. Sokic-Lazic D, Minteer SD. 2008. Citric acid cycle biomimic on a carbon electrode. Biosens Bioelectron 24(4):939–944.
35. Vasic-Racki D. 2006. History of industrial biotransformations—Dreams and realities. In: Liese A, Seebald S, Wandrey C, editors. Industrial biotransformations. Weinheim: Wiley-VCH KGaA. p 1–37.
36. Zhang Y-HP, Lynd LR. 2004. Toward an aggregated understanding of enzymatic hydrolysis of cellulose: Noncomplexed cellulase systems. Biotechnol Bioeng 88:797–824.
37. Welch P, Scopes RK: Studies on cell-free metabolism: ethanol production by a yeast glycolytic system reconstituted from purified enzymes. J Biotechnol 1985, 2:257-273.
38. Wichmann R, Vasic-Racki D. 2005. Cofactor regeneration at the lab scale. Adv Biochem Eng Biotechnol 92:225–260.
39. Zhang Y-HP: A sweet out-of-the-box solution to the hydrogen economy: is the sugar-powered car science fiction? Energy Environ Sci 2009, 2:272-282.
40. Zhong JJ. 2001. Biochemical engineering of the production of plant-specific secondary metabolites by cell suspension cultures. Adv Biochem Eng Biotechnol 72:1–26.





