빛을 이용한 세포단백질 기능 조절

서울대학교 약학대학 이지연 교수
1. 개요
세포내에서 바이오부품들의 기능을 시간적 공간적으로 정확하게 조절할 수 있는 시스템을 확립하는 것은 합성생물학이 추구하는 중요한 목표중 하나라고 할 수 있다 (Medema et al., 2011). 생물학에 있어 최근 주목받고 있는 두 가지 테크놀로지는 빛에 반응하는 단백질을 엔지니어링하여 기능을 조절하는 optogenetics 분야와 염기서열 특이적인 DNA 결합 단백질을 이용한 genomic modification이라 할 수 있는데 합성생물학적 접근을 통해 이러한 단백질부품들을 효율적으로 분할 조립할 수 있다면 세포내의 다양한 프로세스를 효과적으로 조절 할 수 있을 것으로 예상된다 (Moglich and Hegemann, 2013; Cho et al., 2013). 적합한 파장의 빛을 선별하여 세포내의 국한된 지역에 조사(illumination)함으로써 원하는 부품의 기능을 조절하여 세포내 독성이 적으면서도 실시간으로 가역적인 변화를 일으킬 수 있는 비파괴적인 (non-invasive) 방법은 빛을 이용한 방법이 유일하다고 할 수 있다. 지난 수 년간 optogenetics 분야에서는 유전자 재조합을 이용한 빛에 반응하는 단백질을 사용하여 세포 기능을 조절하는 첨단의 연구를 보고하고 있다 (Moglich et al., 2009; Morgan et al., 2010; Ohlendorf et al., 2012; Zhou et al., 2012;Yin et al., 2013). 본 보고서에서는 optogenetics 분야의 최근 연구동향을 분석해보고자 한다.
2. 세포 단백질의 기능 조절
Yang group에서 발표한 LightOn 유전자발현 시스템은 Gal4-VVD 도메인 융합에 의해 빛에 의해 VVD 도메인의 dimerization을 조절함으로써 UASG 서열에의 결합에 의한 transgene의 발현을 조절하였다 (Wang et al., 2012). LightOn은 낮은 background와 빠른 kinetic, 그리고 가역적 반응을 통한 유전자의 induction을 빛에 의해 조절하였고 광원도 태양광에 비해 훨씬 낮은 청색광을 연속적인 illumination 이 아닌 pulse에 의해 조절하고 빛에 극히 민감한 VVD 단백질을 사용함으로써 독성을 낮출 수 있었다.
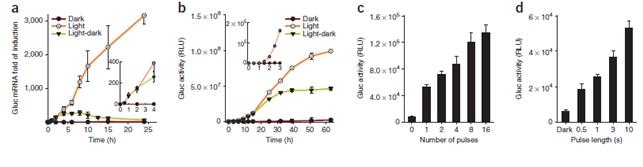
그림 1. LightOn 시스템을 이용하여 유전자 발현을 조절한 연구에서의 expression kinetic 및 light pulse 혹은 duration 시간의 조절에 따른 발현 정도의 차이.
Camilli group에서는 세포막의 지방성분으로 세포내 다양한 기능을 조절하는 것으로 알려진 Phosphoinositides (PIs)의 세포내 레벨을 빛을 이용하여 빠르고 국소적으로 그리고 가역적으로 조절하는 연구를 보고한 바 있다 (Idevall-Hagren et al., 2012). 식물에서 유래한 빛에 반응하는 단백질인 cryptochrome 2 (CRY2)와 전사조절 인자인 CIBN 단백질 사이의 dimerization을 청색파장의 빛을 조사함으로써 유도하고 5 ptaseOCRL (inositol 5 phosphatase domain of OCRL)를 세포막으로 유인하여 PI(4,5)P2와 PI(3,4,5)P3 탈인산화를 유도하였다. 5 ptase 는 세포막에 존재하는 PI(4,5)P2와 PI(3,4,5)P3 레벨을 조절하지만 세포내에서 국소적 조절을 하지 못하는 것으로 알려져 있었으나 빛에 의해 유도되는 dimerization 현상을 엔지니어링하여 5 ptase를 세포막으로 이동시켜 Phosphoinositides(PIs)의 레벨을 공간적으로 가역적으로 그리고 빠르게 조절 가능하였다.
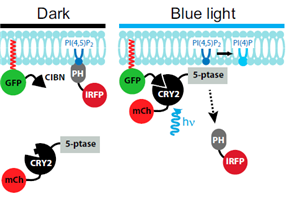
그림 2. 빛에 의해 5-ptase 를 plasma membrane으로의 이동시켜 PI(4,5)P2의
탈인산화를 빠르게 유도하는 과정.
2013년 Zhang group에서는 전사조절을 위한 모듈로서 genomic anchor로 Xanthomonas sp 에서 유래한 TALEs (transcription activator-like effectors)과 Arabidopsis thaliana 에서 유래한 cryptochrome 2 (CRY2)을 사용하여 빛이 있는 상태에서는 TALE–CRY2 단백질이 counterpart인 CIB1 단백질에 결합하여 CIB1에 연결된 effector domain에 의해 전사를 활성화시킬 수 있는 모듈화 가능한 시스템을 소개한 바 있다 (Konermann et al., 2013). 빛의 파장, 빛의 세기, 빛에 의한 활성화상태 유지기간 (duty cycle)등에 대한 체계적인 연구와 더불어 activation domain에 대한 선별을 통해 최적화된 TALE–CRY2PHR/CIB1–VP64을 찾아내었다. 주목할 점은 소분자에 의해 조절되는 TALE 시스템에 비해 on/off kinetic이 빛을 이용한 조절에서 더 효율적으로 진행될 수 있었다는 점이다.
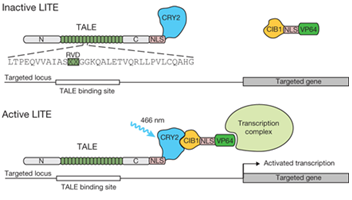
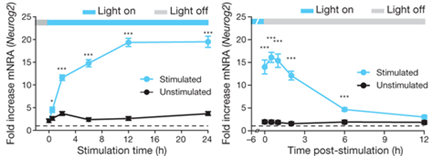
그림 3. LITE 시스템 디자인과 빛에 의한 전사변화.
CRY2 단백질의 경우에는 빛에 의해 oligomerization 프로세스가 조절됨으로써 세포내 시그널을 활성화 시키는 것으로 최근에 밝혀졌다 (Bugaj et al., 2013). 세포내 시그널링의 조절에 있어서 oligomerization은 감도높은 디지털화된 신호반응을 제공함과 더불어 나노 스케일의 단백질 활성을 마이크로 스케일의 세포내 구조에 의한 조절로 연결함으로써 질병에 관여하는 효소의 활성조절에 있어 scaffold를 제공하는 것으로 알려져 있다. CRY2 단백질의 PHR (Photolyase homology region) 도메인과 연결된 mCherry 단백질(CRY2 mCherry)의 경우 HEK 293T 세포내에서 청색광을 조사한지 10초 안에 cluster를 형성하고 빛을 제거하면 수분안에 해리되는 가역적 과정을 진행함이 관찰되었다. 이러한 과정은 빛의 유무에따라 지속적으로 반복될 수 있었으며 빛을 제거시 cluster 수의 감소에 있어 약 5.5분에 해당하는 시간 상수는 이전에 보고된 세포내 활성화된 Cry2 photoisomer 의 lifetime (t1/2)과 일치함을 알 수 있었다.
CRY2 mCherry 클러스터 형성 모듈이 oligomerization에 의존하는 시그널링 시스템에 적용될 수 있는지 확인하기 위해 LRP6 C–terminal domain (LRP6c)을 CRY2 mCherry에 융합함으로써 빛에 의해 유도되는 클러스터 형성이 Wnt/b–catenin 신호전달경로를 변화시킴을 확인하였다. 또한 세포의 mobility에 관여하는 것으로 알려진 Rho GTPase Rac1의 oligomerization을 빛에 의해 유도하여 HEK 293T 세포내에서 cytoplasm에서 세포막으로 mCherry의 형광이 이동함을 보임으로써 빛에 의해 Rac1이 활성화됨을 규명하였다.
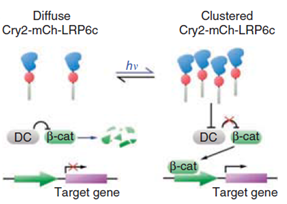
그림 4. 빛에 의해 유도되는 Cry2-LRP6c 의 클러스터링을 통한
Wnt/b-catenin 시그널링 경로 조절의 예.
3. 고찰
전술한 바와 같이 합성생물학적 응용을 위한 스위치의 개발과 효과적인 빛 조절 시스템 확립을 위해서는 바이오부품으로서의 단백질의 특성 및 세포내 신호전달에 있어 작용기전에 대한 연구가 선행되어야 할 것이다. 세포 내에서 일어나는 다양한 단백질들의 프로세스에 대한 이해와 더불어 합성생물학적 접근으로 optogenetics에서 해결가능한 문제가 무엇인지 그리고 소분자 화합물을 이용한 조절보다 우수한 점이 무엇인지에 대한 문제인식이 매우 중요하다고 할 수 있다. 또한 빛을 통한 효율적인 세포내 단백질 기능 조절에 있어서의 빛 스위치의 기능평가는 빛의 유무에 따라 몇 배의 차이가 나는가에 대한 규명뿐만 아니라 얼마나 빨리 활성/비활성 상태로 전환될 수 있는지에 대한 시간적 조절에 대한 연구가 필수적으로 수행되어야 할 것으로 사료된다.
4. 참고문헌
1. Bugaj, L.J., Choksi, A.T., Mesuda, C.K., Kane, R.S., and Schaffer, D.V. (2013). Optogenetic protein clustering and signaling activation in mammalian cells. Nature methods 10, 249-252.
2. Cho, S.W., Kim, S., Kim, J.M., and Kim, J.S. (2013). Targeted genome engineering in human cells with the Cas9 RNA-guided endonuclease. Nature biotechnology 31, 230-232.
3. Idevall-Hagren, O., Dickson, E.J., Hille, B., Toomre, D.K., and De Camilli, P. (2012). Optogenetic control of phosphoinositide metabolism. Proceedings of the National Academy of Sciences of the United States of America 109, E2316-2323.
4. Konermann, S., Brigham, M.D., Trevino, A.E., Hsu, P.D., Heidenreich, M., Cong, L., Platt, R.J., Scott, D.A., Church, G.M., and Zhang, F. (2013). Optical control of mammalian endogenous transcription and epigenetic states. Nature 500, 472-476.
5. Medema, M.H., Breitling, R., Bovenberg, R., and Takano, E. (2011). Exploiting plug-and-play synthetic biology for drug discovery and production in microorganisms. Nature reviews Microbiology 9, 131-137.
6. Moglich, A., Ayers, R.A., and Moffat, K. (2009). Design and signaling mechanism of light-regulated histidine kinases. J Mol Biol 385, 1433-1444.
7. Moglich, A., and Hegemann, P. (2013). Biotechnology: Programming genomes with light. Nature 500, 406-408.
8. Morgan, S.A., Al-Abdul-Wahid, S., and Woolley, G.A. (2010). Structure-Based Design of a Photocontrolled DNA Binding Protein. Journal of Molecular Biology 399, 94-112.
9. Ohlendorf, R., Vidavski, R.R., Eldar, A., Moffat, K., and Moglich, A. (2012). From Dusk till Dawn: One-Plasmid Systems for Light-Regulated Gene Expression. Journal of Molecular Biology 416, 534-542.
10. Wang, X., Chen, X.J., and Yang, Y. (2012). Spatiotemporal control of gene expression by a light-switchable transgene system. Nature methods 9, 266-U264.
11. Yin, T., and Wu, Y.I. (2013). Guiding lights: recent developments in optogenetic control of biochemical signals. Pflugers Archiv : European journal of physiology 465, 397-408.
12. Zhou, X.X., Chung, H.K., Lam, A.J., and Lin, M.Z. (2012). Optical Control of Protein Activity by Fluorescent Protein Domains. Science 338, 810-814.





