합성 생물학의 유전자 회로를 간단하게 설명할 때 또는 설계를 위한 롤 모델로써 전자기 회로와의 비교가 종종 이용된다. 그러나 이들은 근본적인 차이를 갖고 있다. 전자기적 회로 구성에 근간이 되는 PCB (Printed Circuit Board)에는 동일한 종류 혹은 동일한 기능을 하는 장치, 예를 들면 콘덴서 (condenser) 와 다이오드 (diode)와 같은 장치들을 하나의 PCB에 여러 개가 설치되어도 문제가 되지 않는다. 우리가 일상에서 이용하는 컴퓨터, 휴대폰 및 TV 등의 전자 제품에 포함된 전기 회로들 역시 이렇게 구성되어 있다 (그림 1A). 그러나 합성 생물학의 plateform이 되는 세포에 PCB처럼 동일한 장치 여러 개를 설치하는 것은 극히 어렵다. Plateform으로써 세포는 PCB처럼 고정된 형태가 아닌 유동적인 특성을 갖고 있기 때문이다. 물론 plateform의 기본 물질이 되는 세포질은 세포내 존재하는 많은 수의 생체 분자들과 bacterial microcompartments (BMC)[1]와 같은 분획된 영역의 존재로 인해 우리가 일반적으로 관찰할 수 있는 액체들과 같은 자유도를 갖지 않으나[2], PCB와 비교해 볼 때 세포내 설치된 유전자 회로들 사이의 간섭이 일어날 확률은 매우 높으며, 이러한 결과가 여러 가지로 보고되고 있다. 따라서 하나의 세포에 설치된 유전자 회로들의 독립적인 구동이 전제되려면, 각 회로마다 각기 다른 부품을 이용해 제작해야한다. 이러한 이유로 다수의 유전자 회로를 하나의 세포에 설치할 때 요구되는 부품의 수가 빠르게 증가하게 된다. 예를 들면 두 개의 2개의 프로모터와 전사인자로 구성된 toggle switch[3]를 하나의 세포에 설치하는 것을 고려할 때, 전자기 회로와 같다면 몇 개를 설치하여도 필요한 2개의 프로모터와 전사인자만 있으면 된다. 그러나 세포에 두 개를 설치하기 위해서는 4, 세 개일 때는 6개, 10개 일 때는 20개의 프로모터와 전사인자가 필요하다 (그림 1)[4]. 따라서 합성 생물학의 궁극적이 목표 달성하기 위한 다기능의 복잡한 유전자 회로를 제작하기 위해서 다양하고 많은 부품 확보가 요구된다.
그림 1. 전자기 회로와 유전자 회로. a, 동일한 condenser들이 장착된 PCB, b, 유전자 회로의 toggle switch
2. 유전자 회로 부품의 확보
유전자 회로 구성을 위한 부품 확보는 크게 두 가지 방법을 통해 이뤄지고 있다. 하나는 plateform으로 이용되는 숙주와 근연관계가 먼 이종 세포로부터 유래한 자연 회로 (세포가 외부 혹은 내부 환경 변화에 대응하기 위해 갖고 있는 고유의 network를 통칭한다) 로부터 부품을 얻는 것이다. 이 같은 방법을 통해 논리 회로를 제작한 대표적인 예로, Pseudomonas syringae로부터 유래한 co-activating 전사 인자 HrpR, HrpS와 이들이 인식하는 cis-전사인자로 sigma 54-depnendent hrpL promoter를 함께 E. coli에 이식해 조작성 (modularity) 과 독립성 (orthogonality)를 확보한 AND, NOT 및 NAND gate를 제작한 보고가 있다[5]. 또 다른 방법은 자연 회로에 존재하지 않는 인공 부품을 제작하는 것이다. 진핵 세포의 전사 인자가 DNA 인식을 위해 zinc finger domain을 주로 이용한다는 것을 근거로, 인공의 DNA 서열을 인식할 수 있는 인공 zinc finger domain을 제작하여 효모 안에 인공 유전자 회로를 제작한 보고가 있다[6]. 이와 더불어 원핵세포에서 DNA 인식에 주로 이용되는 helix-turn-helix motif로 진핵 세포에 적용 인공 전사인자를 제작함으로써 독립성을 확보한 예 또한 존재한다.
그러나 현재까지 제작된 대부분의 유전자 회로와 논리 회로는 신호의 입력, 계산 또는 연산과 출력에 이르는 모든 과정에서 전사 또는 번역 과정을 근간으로 하고 있다. 따라서 다중 입력이 필요한 유전자 회로 또는 다층 구조의 논리 회로를 구성하는 경우 요구되는 전사 인자의 수는 증가하며, 활용 가능한 부품의 수는 빠르게 고갈 된다(그림 2). 또한 신호의 처리과정에서 최소 2번의 전사와 번역과정을 요구하기 때문에 유전자 회로의 입∙출력 간격이 길고 복잡한 구조를 갖게 된다. 이는 결국 유전자 회로의 반응성 감소를 유발하여 실제로 설계된 실험을 검증하는데 많은 어려움을 겪는다. 따라서 유전자 회로의 실 응용을 위해 요구되는 독립성과 반응성이라는 두 마리 토끼를 잡기 위해서는 전사 또는 번역인자에 의존한 부품 외에 다른 형태의 부품의 도입 유용할 수 있을 것으로 사료된다.
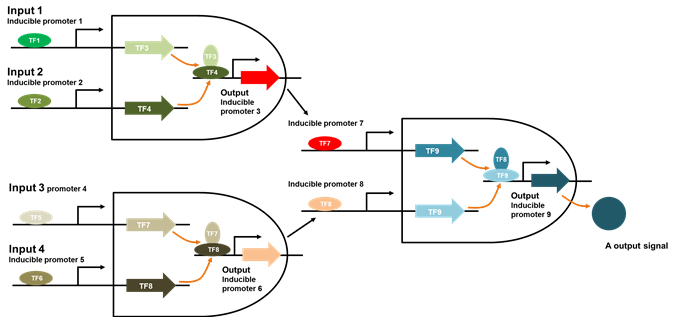
그림 2. 전자 인자를 기반으로 한 4 input AND 게이트, 유전자 회로 장치가 아닌 논리 회로의 제작을 위해 총 9개의
프로모터와 전사 인자 쌍과 출력 신호를 얻기 위해 3번의 전자, 번역과 접힘 과정의 반복이 필요함.
3. Intein 과 protein splicing
Intein은 진핵세포 RNA의 intron에 대응하는 단백질로, 진핵 세포, 원핵세포 및 고 세균에서 발견되고 있으며, 최근까지 500 여종 이상 발견되고 있다 (http://tools.neb.com/inbase/). Protein splicing은 intein을 가진 단백질이 겪는 자발적 반응으로, 단백질의 접힘 과정 이후에 intein의 N-과 C-terminal에 인접한 extein (intein이 분리된 후 잔류하는 성숙한 단백질) 의 peptide 결합의 절단과 접합 과정을 통해, intein과 N-과 C-extein이 peptide bond로 결합된 성숙한 두 개의 단백질 분리 생성되는 과정을 말한다[7]. Intein의 일반적인 protein splicing은 4 단계 과정으로 일어나며, 첫 번째 단계에서 intein과 N-extein 사이의 peptide bond가 intein의 N-terminal에 존재하는 cysteine 또는 serine 잔기의 친핵성 공격을 받아 thioester 또는 ester 전환이 일어난다. 그 후 trans-esterification을 통하여 N-extein이 N-intein의 첫 번째 잔기에서 C-intein (주로 cystein, serine 또는 threonine) 의 첫 번째 잔기로 이동한다. 이 과정에서 N과 C extein과 intein의 C-말단이 결합된 형태가 되며 N-extein이 ester 결합을 통해 곁가지를 형성하게 된다. 그 후 N-extein과 C-extein을 연결하는 ester 작용기가 intein의 G motif의 보존 서열인 asparagine 잔기의 cyclization 에 의해 끊어지며, extein간의 ester 결합이 유지된 형태로 intein과 분리되며, 분리된 intein의 C-terminal에는 aminosuccinimide가 형성된다. 마지막 단계에서 N 과 C-extein을 연결하고 있는 ester bond는 O-N 또는 S-N acyl 재배열을 통하여 본래의 peptide 결합이 형성되며, intein의 C-terminal에 형성된 aminosuccinimide 는 자발적인 수화를 통해 일반적인 단백질의 C-말단 형태로 돌아가 온전한 형태의 두 개의 단백질로 분리 된다 (참조: http://tools.neb.com/inbase/proteinSplicing.swf 에서 플래시로 protein splicing 과정을 볼 수 있다).
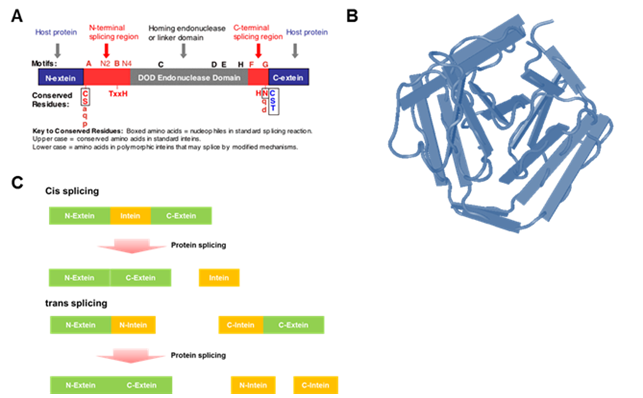
그림 3. Intein 과 protein splicing. A; protein splicing과 관련된 4개의 보존 영역이 붉은 알파벳 (A, B, F, G)로 표시됨. B; Synechocystis sp. PCC 6803으로부터 유래한 Ssp DnaB intein의 3차 구조 (PDB ID:1MI8)로 고슴도치 (Hedgehog) 가 몸을 말고 있는 모양임. Intein은 단백질의 일차 서열의 차이에도 불구하고 이와 유사한 3차 구조를 갖고 있음 , C; Cis splicing과 split intein의 trans splicing의 모식도임
Intein의 protein splicing은 하나의 미성숙 단백질에서 일어나는 cis splicing외에 두 개의 미성숙 단백질 사이에서 일어나는 trans splicing으로 구분된다(그림 3C). Trans splicing이 일어나는 trans intein은 자연적으로 존재하기도 하지만, large intein에서 protein splicing과 관련되지 않은 DOD domain (그림 3A) 을 제거하는 방법 또는 mini-intein의 linker 영역을 절단하는 단백질 공학적 기법을 통하여 인공적으로 제작되기도 한다. 뿐만 아니라 펩타이드 결합을 intein의 양 말단이 아닌 한쪽에서만 일어나도록 변형한 것들 또한 존재한다. Intein의 cis- 와 trans-splicing은 생명 공학 분야에서 여러 가지 방법으로 활용되고 있다.
4. Intein의 활용
Protein splicing, N 또는 C 말단 근처의 펩타이드 결합의 절단 능력을 비롯하여, 두 개의 단백질 사이에서 일어나는 trans splicing은 생물 공학 분야에서 다양하게 활용되고 있다. 이들을 간략하게 소개하면 다음과 같다. Intein의 간단한 생명공학적 활용분야 중 하나는 변성에 대한 내성을 증가시키기 위한 전략 중 하나로 종종 활용되고 있는 환형화에서 찾아 볼 수 있다. Protein splicing을 이용한 단백질의 환영화는 대상이 되는 단백질 또는 펩타이드의 N 과 C 말단에 trans intein의 N과 C 부분을 융합시켜 발현 시키는 것(IC-Protein-IN또는 IN-protein-IC)으로 간단하게 이룰 수 있다[8, 9]. 또한 미성숙된 단백질(기능이 없는 단백질)이 intein의 분리 후 성숙한 단백질(기능의 회복)로 전환되는 현상을 이용해, 세포내 독성을 가져 in vivo에서 생산이 어려운 독성 단백질에 intein을 in-frame fusion 하여 비독성 단백질로 전환해 발현하는 방법을 통해 과생산하는 공정에도 활용되었다[10]. Protein splicing 과정에서 intein의 N 과 C 말단에 인접한 펩타이드 결합을 절단하는 특성을 활용해 protease로 이용한 보고가 있다[11]. 특히 기존의 protease의 경우 인식 서열이 존재하는 영역 근처의 3차 구조에 영향을 받기 때문에 대상 단백질에 따라 절단 효율 및 특이성에 차이가 나타나는 것과 달리, intein protease의 경우 대상 단백질이 아닌 intein의 N과 C 영역의 3차 구조적 상보성에 근거하여 대상 단백질을 절단하기 때문에 비교적 높은 특이성을 유지할 수 있다는 장점이 있다. 이러한 구조적 상보성과 intein의 N 또는 C 말단만을 특이적으로 절단할 수 있는 특성은 단백질 분리 정제를 위해 활용되기도 한다. Intein을 이용한 단백질의 정제 과정은 다음과 같다. Trans intein의 N 또는 C 영역에 affinity tag (가장 많이 활용되는 예는 Maltose binding domain 또는 Chitin binding domain 이다.)을 융합하고, 다른 한쪽에는 대상 단백질을 융합하여 각각을 독립적으로 발현시킨다. Affinity tag이 융합된 부분을 적절한 column 또는 resin에 결합시킨 뒤, 대상 단백질을 흘려보내면 trans intein의 N과 C 영역이 상호작용하여 대상 단백질과의 펩티드 결합이 끊어 단백질을 tag이 없는 형태로 정제 할 수 있다[12]. 이러한 방법은 정제 후, affinity tag의 분리를 위한 추가적인 과정이 필요 없는 장점을 갖는다.
이 외 intein이 가장 널리 활용되고 있는 분야는 expressed protein ligation (EPL)으로, 용어에서 알 수 있듯이 번역과 접힘 과정이 끝난 단백질 또는 펩타이드들을 결합시키는 분야 이다. EPL은 단백질의 인산화, lipidation, 당화, biotinylation, ubiquitination, 동위 원소 표지뿐만 아니라 비자연적인 아미노산 예를 들어 형광이 표지되거나 화학적으로 변형된 아미노산을 갖는 펩타이드를 접합할 때 이용되고 있다[13]. 이 기술은 특히 살아있는 세포 표면 또는 세포내 존재하는 단백질을 특이적으로 표지할 때 유용하게 활용할 수 있다. 그 예로, Chinese hamster ovary (CHO) cell 표면에 있는 human transferrin receptor를 Ssp GyrB split intein을 이용하여 5-carboxy-fluorescein으로 형광 표지 한 보고가 있다. 또한 Npu DnaE intein의 C 영역을 막단백질과 융합하고 enhanced GFP (eGFP)를 N 영역과 융합한 두 단백질을 대장균에서 동시 발현시킴으로서, eGFP를 transmembrane 또는 GPI-anchored protein에 표지를 한 예 등이 있다[14, 15].
5. Intein을 활용한 유전자 회로 부품 개발 동향
기능이 없는 미성숙 단백질을 기능을 갖는 성숙한 단백질로의 전환시키는 intein을 대상 단백질에 적용하면 유전자 회로의 스위치와 같은 기능을 수행 할 수 있는 부품을 제작할 수 있을 것이다. 이렇게 제작한 스위치는 전사 인자의 up/down (생체 회로가 갖는 scout 기능 또는 빠른 반응을 위해 일정 수준 이상 존재해야하기 때문에 발생하는 특성) 방식의 스위치가 아닌 on/off의 진정한 스위치로의 활용이 가능하다. 이 목적을 달성하기 위해서는 intein의 protein splicing의 조절이 전제 되어야 한다(이를 conditional protein splicing; CPS라고 한다). 가장 먼저 시도된 CPS는 Sce VMA (Saccharomyces cerevisiae의 large intein)의 DOD domain을 제거하여 제작한 split intein의 N과 C영역을 rapamycin binding domain인 FKBP12 와 FRB에 각각 융합함으로써, rapamycin이 존재는 환경에서 protein splicing이 일어나도록 한 것이다 [16, 17] (그림 4A). 이 기술은 Drosophila melanogaster에 적용하여 세포내 fire fly luciferase의 활성을 조절하는데 활용되었다. 앞서의 예가 rapamycin에 의해 protein이 splicing이 유도되는 것과 반대로, 돌연변이 FKBP12를 이용해 rapamycin이 존재할 때 protein splicing이 억제되도록 만들거나 [18], FKBP12 와 FRB를 antiparallel coiled-coli로 치환하여 이들 간에 상호작용으로 protein splicing이 일어나도록 제작되기도 하였다 [19]. Trans splicing 뿐만 아니라, cis splicing를 활용하여 하나의 단백질을 활용한 스위치 역시 제작된 예 가있다. Mtu RecA (Mycobactrium tuberculosis로부터 유래한 large intein)의 DOD (homing endonuclease domain)을 human estrogen receptor의 ligand binding domain으로 치환함으로써 4-hydroxytamoxifen (4HT)에 대응해 protein splicing이 일어나도록 제작한 스위치가 있다 [20, 21] (그림 4B). 이 시스템은 이후에 mammalian cell에서 fluorescent reporter 또는 전사 인자가 4HT에 의해 기능을 회복하도록 하는데 적용되었다. 뿐만 아니라 estrogen receptor가 아닌 human hormone receptor β로 치환한 스위치를 β-galactosidase 와 β-lactamase에 장착해 thyroid hormone의 농도에 따라 각각의 단백질 활성을 회복시킨 보고 또한 존재한다[22]. 특정 분자에 대한 스위치 외에, 환경 변화를 통한 CPS역시 보고 되고 있다. 고온성 미생물에서 분리한 intein의 경우 온도에 따라 protein splicing의 효율이 달라지는데, 이를 이용해 효모와 D. melanogaster에서 온도에 따라 Sce VMA intein의 protein splicing을 조절하여 전사인자 Gal4 와 Gal80의 기능을 회복시킴으로써 두 전사인자의 대상이 되는 유전자의 발현 조절에 이용하였다. 뿐만 아니라 T7 RNA polymerase에 CPS를 적용하여 온도에 따라 T7 promoter의 downstream에 위치한 유전자의 발현 양을 조절한 보고도 존재한다[23, 24]. CPS를 전사 인자의 기능 회복에 적용한 이와 같은 보고는, 전사 단계에서 유전자의 발현을 광범위하게 조절하는데 intein이 적용된 스위치를 활용할 수 있음을 시사한다.
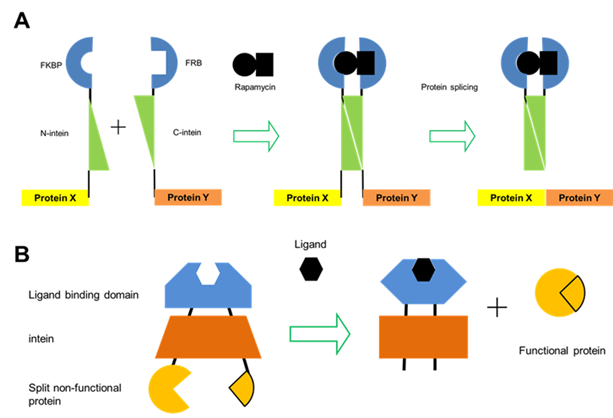
그림 4. Conditional protein splicing (CPS). A; cis splicing을 이용한 CPS의 예로 large intein의 DOD domain을 ligand binding domain으로 치환하여, ligand가 결합하였을 때 유도되는 intien의 conformational change에 의해 protein splicing이 일어나 두 개로 분리된 단배백질이 기능을 회복함, B; trans splicing을 이용한 CPS로 intein의 conformational change를 유도하기보다 N과 C영역의 구조적 상보성에 의존하여 두 개로 분리된 단백질의 기능을 회복시킴.
온도뿐만 아니라 photodimerization domain을 이용하여 빛으로 혹은 redox potential [25] 및 pH [26]의 변화로 protein splicing을 조절한 보고 또한 존재하며, 이러한 CPS를 기반으로 intein을 biosensor로서의 활용 또한 보고되고 있다. CPS를 이용한 가장 단순한 형태의 biosensor는 단백질 간의 상호 작용을 확인하는 것 [27]에서부터 DNA methylation [28], protein localization [29, 30], oxidation state [31]및 protease activity [32]를 감지하는 것에 이르기까지 다양하게 활용 가능함이 보고되었다.
앞서 살펴본 것과 같이 intein의 protein splicing을 이용해 스위치와 biosensor를 제작한다면, 일반적인 유전자 회로들이 환경 인자들에 반응하기 위해 전사 인자, 이들에 대응하는 프로모터와 유전자 등의 여러 구성물이 필요한 것과 달리, 하나의 또는 두 개의 단백질로 유전자 회로의 기능을 대체할 수 있을 것으로 생각된다.
6. 고찰
합성 생물학의 기술이 과거 유용 단백질의 대량 생산이나 환경인자의 감지 등의 일차원적인 목표를 구현하는 것이 아니라, 사용자가 원하는 보다 복잡한 목적을 달성하기 위한 인공 세포 혹은 스마트 세포를 제작을 목표로 발전해 가고 있다. 그럼에도 불구하고 현재까지 제작한 대부분의 유전자 회로들이 실질적 활용된 예는 극히 드물다. 이는 생물학적 부품이 여타의 공학(전기, 전자, 화학 등)에서 활용되는 것과 달리 부품의 조합 결과를 분명하게 예측하기 어렵기 때문이라 생각된다. 이를 극복하기 위한 생물학적 부품의 독립성과 조작성을 확보를 위해 많은 연구자들이 노력하고 있다. 그러나 유전자 회로 또는 이들의 유기적인 연결과 논리 연산을 위한 논리 회로를 위한 부품 개발이 전사 인자를 활용하는 것에 집중 되고 있다. 이러한 상황에서 앞서 살펴본 것과 같이 다양한 활용성과 더불어 하나 또는 두 개의 단백질로 스위치와 biosensor 기능의 수행이 가능한 intein은 유전자 회로의 부품 개발에 있어 매우 매력적인 scaffold가 될 것이라 생각된다.
7. 참고 문헌
[1] C.A. Kerfeld, S. Heinhorst, and G.C. Cannon, Bacterial microcompartments. Annu Rev Microbiol 64 (2010) 391-408.
[2] Bradley R. Parry, Ivan V. Surovtsev, Matthew T. Cabeen, Corey S. O’Hern, Eric R. Dufresne, and C. Jacobs-Wagner, The Bacterial Cytoplasm Has Glass-like Properties and Is Fluidized by Metabolic Activity. Cell 156 (2014) 183-194.
[3] T.S. Gardner, C.R. Cantor, and J.J. Collins, Construction of a genetic toggle switch in Escherichia coli. Nature 403 (2000) 339-42.
[4] M.R. Bennett, and J. Hasty, Overpowering the component problem. Nat Biotechnol 27 (2009) 450-1.
[5] B. Wang, R.I. Kitney, N. Joly, and M. Buck, Engineering modular and orthogonal genetic logic gates for robust digital-like synthetic biology. Nat Commun 2 (2011) 508.
[6] M. Folcher, M. Xie, A. Spinnler, and M. Fussenegger, Synthetic mammalian trigger-controlled bipartite transcription factors. Nucleic Acids Res 41 (2013) e134.
[7] H. Paulus, Protein splicing and related forms of protein autoprocessing. Annu Rev Biochem 69 (2000) 447-96.
[8] T.C. Evans, J. Benner, and M.-Q. Xu, The Cyclization and Polymerization of Bacterially Expressed Proteins Using Modified Self-splicing Inteins. Journal of Biological Chemistry 274 (1999) 18359-18363.
[9] J.A. Camarero, and T.W. Muir, Biosynthesis of a Head-to-Tail Cyclized Protein with Improved Biological Activity. Journal of the American Chemical Society 121 (1999) 5597-5598.
[10] J. Miao, W. Wu, T. Spielmann, M. Belfort, V. Derbyshire, and G. Belfort, Single-step affinity purification of toxic and non-toxic proteins on a fluidics platform. Lab on a Chip 5 (2005) 248-253.
[11] G. Volkmann, V. Volkmann, and X.-Q. Liu, Site-specific protein cleavage in vivo by an intein-derived protease. FEBS Lett 586 (2012) 79-84.
[12] D. Guan, M. Ramirez, and Z. Chen, Split intein mediated ultra-rapid purification of tagless protein (SIRP). Biotechnology and Bioengineering 110 (2013) 2471-2481.
[13] T.W. Muir, D. Sondhi, and P.A. Cole, Expressed protein ligation: A general method for protein engineering. Proceedings of the National Academy of Sciences 95 (1998) 6705-6710.
[14] G. Volkmann, and X.-Q. Liu, Protein C-Terminal Labeling and Biotinylation Using Synthetic Peptide and Split-Intein. PLoS ONE 4 (2009) e8381.
[15] T. Ando, S. Tsukiji, T. Tanaka, and T. Nagamune, Construction of a small-molecule-integrated semisynthetic split intein for in vivoprotein ligation. Chemical Communications (2007) 4995-4997.
[16] H.D. Mootz, E.S. Blum, A.B. Tyszkiewicz, and T.W. Muir, Conditional Protein Splicing: A New Tool to Control Protein Structure and Function in Vitro and in Vivo. Journal of the American Chemical Society 125 (2003) 10561-10569.
[17] H.D. Mootz, and T.W. Muir, Protein Splicing Triggered by a Small Molecule. Journal of the American Chemical Society 124 (2002) 9044-9045.
[18] E.C. Schwartz, L. Saez, M.W. Young, and T.W. Muir, Post-translational enzyme activation in an animal via optimized conditional protein splicing. Nat Chem Biol 3 (2007) 50-4.
[19] D.F. Selgrade, J.J. Lohmueller, F. Lienert, and P.A. Silver, Protein Scaffold-Activated Protein Trans-Splicing in Mammalian Cells. Journal of the American Chemical Society 135 (2013) 7713-7719.
[20] S.H. Peck, I. Chen, and D.R. Liu, Directed evolution of a small-molecule-triggered intein with improved splicing properties in mammalian cells. Chem Biol 18 (2011) 619-30.
[21] A.R. Buskirk, Y.C. Ong, Z.J. Gartner, and D.R. Liu, Directed evolution of ligand dependence: small-molecule-activated protein splicing. Proc Natl Acad Sci U S A 101 (2004) 10505-10.
[22] G. Skretas, and D.W. Wood, Regulation of protein activity with small-molecule-controlled inteins. Protein Science 14 (2005) 523-532.
[23] M.P. Zeidler, C. Tan, Y. Bellaiche, S. Cherry, S. Hader, U. Gayko, and N. Perrimon, Temperature-sensitive control of protein activity by conditionally splicing inteins. Nat Biotechnol 22 (2004) 871-876.
[24] R.B. Liang, X.P. Liu, J.H. Liu, Q.S. Ren, P.J. Liang, Z.X. Lin, and X.M. Xie, A T7-expression system under temperature control could create temperature-sensitive phenotype of target gene in Escherichia coli. Journal of Microbiological Methods 68 (2007) 497-506.
[25] L. Berrade, Y. Kwon, and J.A. Camarero, Photomodulation of Protein Trans-Splicing Through Backbone Photocaging of the DnaE Split Intein. Chembiochem 11 (2010) 1368-1372.
[26] J.X. Shi, and T.W. Muir, Development of a tandem protein trans-splicing system based on native and engineered split inteins. Journal of the American Chemical Society 127 (2005) 6198-6206.
[27] T. Ozawa, S. Nogami, M. Sato, Y. Ohya, and Y. Umezawa, A fluorescent indicator for detecting protein-protein interactions in vivo based on protein splicing. Anal Chem 72 (2000) 5151-7.
[28] X. Huang, R. Narayanaswamy, K. Fenn, S. Szpakowski, C. Sasaki, J. Costa, P. Blancafort, and P.M. Lizardi, Sequence-specific biosensors report drug-induced changes in epigenetic silencing in living cells. DNA Cell Biol 31 Suppl 1 (2012) S2-10.
[29] S.B. Kim, T. Ozawa, S. Watanabe, and Y. Umezawa, High-throughput sensing and noninvasive imaging of protein nuclear transport by using reconstitution of split Renilla luciferase. Proc Natl Acad Sci U S A 101 (2004) 11542-7.
[30] T. Ozawa, Y. Sako, M. Sato, T. Kitamura, and Y. Umezawa, A genetic approach to identifying mitochondrial proteins. Nat Biotechnol 21 (2003) 287-93.
[31] B.P. Callahan, M. Stanger, and M. Belfort, A redox trap to augment the intein toolbox. Biotechnol Bioeng 110 (2013) 1565-73.
[32] A. Kanno, Y. Yamanaka, H. Hirano, Y. Umezawa, and T. Ozawa, Cyclic luciferase for real-time sensing of caspase-3 activities in living mammals. Angew Chem Int Ed Engl 46 (2007) 7595-9.





