유산균 발현시스템 개발 현황

충북대학교 식품생명공학과 한남수 교수
1. Lactic acid bacteria
유산균 (젖산균, lactic acid bacteria)은 다양한 식품산업에 이용되고 있는 산업적으로 중요한 미생물로, 다양한 탄소원을 이용하여 빠른 속도로 젖산을 생성하고 이로 인해 식품의 저장기간을 연장시키는 역할을 하며 이외에도 식품에 있어 향기, 물성, 그리고 영양학적으로 유익한 측면을 제공한다. 특히, 치즈나 유산균 발효유로 대표되는 유가공 산업이나 김치 등의 채소발효산업에 흔히 이용되는데, 약 20종의 다양한 genera의 유산균 중 식품산업에서는 Lactococcus, Lactobacillus, Leuconostoc, Oenococcus,
Pediococcus, 그리고 Streptococcus가 많이 이용 되고 있다.
유산균의 대사경로는 생물공학적으로 사용되는 다른 미생물에 비해 단순하여 합성능력과 생산되는 대사물질의 다양성이 제한되는 반면, 오히려 단순한 대사경로는 본 미생물을 대사공학적 용도로 개발하는 데 있어서 장점으로 평가된다. 더욱이 에너지 대사경로와 생합성 경로가 거의 완벽하게 분리되어 있어 서로 간에 영향을 미치지 않는 점은 큰 장점으로 간주된다. 유산균을 이용한 생물공학적 연구는 대표적으로 Lactococcus lactis를 이용하여 다양한 대사공학적 시도들을 성공적으로 수행하며 활발히 진행되어 왔다. 본 연구동향에서는 지금까지 개발된 유산균의 유전자 재조합 기술들을 소개하고 이들을 바탕으로 수행된 다양한 대사공학적 연구 사례를 정리하였다.
2. Food-grade concept: Consideration of regulatory framework
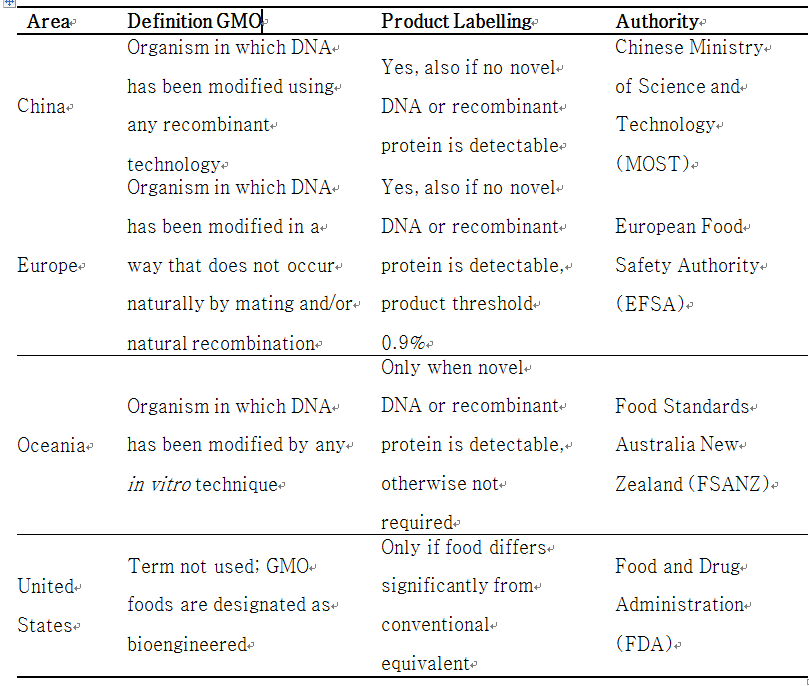
재조합 food-grade 유산균을 단백질, 효소와 같은 다양한 물질들을 생산할 수 있는 세포공장으로서 새롭게 이용하기 위해서는 우선 유산균의 안전한 사용을 위한 법률 체계에 대한 이해가 필요하다. [de Vos 1999a; Salminen et al. 1998; Sybesma et al. 2006]. 예를 들어Lactobacillus균은 food-grade 미생물이지만 GMO(genetically modified organism)로써 식품에 이용하기 위해서는 엄격하게 규제를 받고 있다[Gruère and Rao 2007; Renault 2002].
식품에 GMO의 사용규제는 전세계적으로 다르게 규정되어 있는데 [Gruère and Rao 2007; Renault 2002], 미국의 경우에는 약간의 규제만을 하는 반면, 유럽이나 오세아니아에서는 식품생산에 GMO의 이용 규제를 엄격히 준수하고 있다. 또한, "유전자 변형(Genetic modification) "과 GMO의 정의는 국가와 관련 기관에 따라 다르게 정의되고 있다. 미국의 경우 "유전자 변형 "은 어떤 기술을 이용하여 DNA sequence를 변형시킨 것으로, 그 돌연변이 균주의 특성에 따라 승인이 되며 [FDA 2001], 재조합 DNA기술을 이용하여 개량된 미생물로 제조된 식품은 “bioengineered foods”이라 하고 GMO라는 용어는 사용하지 않는다 [Pedersen et al. 2005]. 미국의 규정에 의하면 GM(genetically modified) 유산균은 GRAS라 분류되며 몇 년 동안 식품 산업에서 시장을 형성하고 있다. 대조적으로 유럽의 유산균 시장은 자연적으로 발생하지 않고 in vitro에서 개량된 모든 미생물들을 GMO로 간주하고[EC 2001], 오세아니아에서는 in vitro 기술을 이용한 몇 가지 규정된 유전적 기술을 이용하여 만들어진 미생물만을 GMO라 정의한다 [Hobbs 2001].
Lactobacilli는 독소가 없고, 건강증진 효과를 주는 프로바이오틱으로써 식품생산공정에 수 천년 동안 이용이 되고 있는 GRAS이고 QPS(Qualified Presumption of Safety) 미생물로 지난 10년 동안 재조합 발현숙주로 꾸준히 이용되어 왔다. 또한, Lactococcus lactis 유산균 모델은 1990년 초에 개발된 이후로 지난 10년 동안 단백질 재조합 발현시스템으로써 발전되어 왔다 [Kleerebezem et al. 1997; Konings et al. 2000; Mierau and Kleerebezem 2005].
GM-유산균를 이용한 발현 시스템은 식품의 안전한 사용을 위해 몇 가지 충족되고 고려될 사항이 있는데, 이를 "Food-grade concept"이라 한다. 이 용어는 유산균 발현시스템이 처음으로 개발된 1990년대부터 사용되었고, Johansen [1999]에 의해 food-grade 발현 시스템의 엄격한 정의 및 기준은 다음과 같이 설명되었다. Food-grade 발현시스템의 가장 중요한 기준은 유전 공학적 용도로 사용되는 숙주는 안전하고, 안정적인 특징을 가지고 있으며, GRAS 또는 QPS 이어야 한다. 더불어 식품과 호환 가능한 선발 표지(selectable maker)를 사용해야 되는데, 항생제 저항 유전자 표지는 배제되어야 하고 숙주 나 발현 시스템에 의해서 해롭거나, 독소를 생성하거나, 알레르기를 일으키는 성분이 생성되지 않아야 되고, 모든 유전적 변형은 자가 복제로 이뤄져야 한다. 또한, food-grade 시스템으로써 또 다른 중요한 특징은 바이오산업이나 식량 생산 산업에 있어서 대규모로 산업에 응용가능하며 사람이 food-grade modified된 유산균을 섭취하였을 때 위장관에서 안정적이어야 한다. 엄격한 food-grade는 같은 genus의 종에서 유래한 유전자나 식품 미생물에서 얻은 유전자를 가진 유산균군으로 정의 할 수 있다. 넓은 범위로는 최종적으로 food -grade 균주의 DNA가 완전히 제거가 되었을 때, non-GRAS 또는 QPS 미생물에서 유래한 유전자도 승인이 된다. 이것은 식품 효소와 EFSA(European Food Safety Authority )의 안내에 관한 현재 EC 규정과는 대조적으로[EC 2008; EFSA 2009], 식품효소에 대한 EC 규제는 안전에 대해 상세 평가 후, 각 효소에 대해 안전성이 확보되면 승인 후에 식품에 첨가 될 수 있다.
Food-grade concept를 기초로 하여 많은 시스템들이 지난 20년간 발전해 왔고, 특히 재조합 Lactococcus와 Lactobacilli의 발현 시스템의 이용이 증가되어 왔다. 다양한 종류의 Lactobacilli 숙주와 프로모터, food-grade 선발 표지가 개발되었고 [Diep et al. 2009; Morello et al. 2008], 이 시스템을 이용한 재조합 효소와 생백신(live vaccine)의 생산 연구가 관심을 받고 있다.
표1: Guidelines for the use of GMO in food products in several regions[Carter and Gruère 2007]
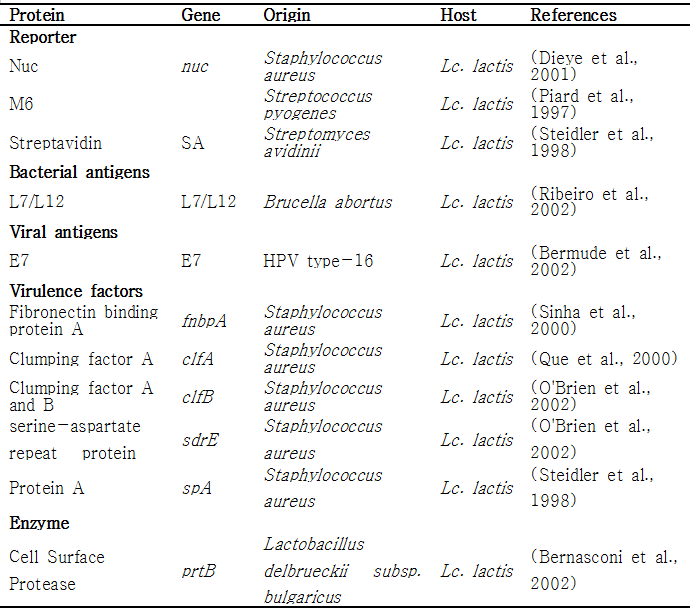
3. Lactic acid bacteria for recombinant protein production
미생물을 유전적으로 변형하고 재조합 미생물로 이용하기 위한 첫 번째 과정은 형질전환기술을 이용하여 외래 유전자를 미생물 내로 도입하는 것이다. 1980년 말에 Lactobacilli의 형질전환에 관한 연구가 처음 발표된 이래로, 다양한 종류의 Lactibacilli가 재조합 단백질 생산에 이용이 되었다. [Aukrust and Blom 1992; Aukrust and Nes 1988; de Vos 1987; Natori et al. 1990]. Electroporation, protoplast formation, conjugation methods등의 형질전환기술들이 발전되어 Lb. acidophilus, Lb. casei, Lb. helveticus, Lb. plantarum Lb. reuteri, Lb. sakei, 와 Lb. pentosus들 유산균에 외래 유전자를 도입하여 재조합 Lactobacilli로 부터 외래 단백질 (heterologous protein) 및 다양한 origin의 antigen을 생산할 수 있었으며 [Bermudez-Humaran et al. 2011; Tarahomjoo 2012; Wells and Mercenier 2008] [Hashiba et al. 1992; Kok 1996; Pouwels and Leer 1993; Wanker et al. 1995], 이외에도 다양한 종류의 유산균에서 많은 단백질이 성공적으로 발현, 생산되었다 (표2).
Table 2. Lactobacilli which have been used for the recombinant expression of proteins
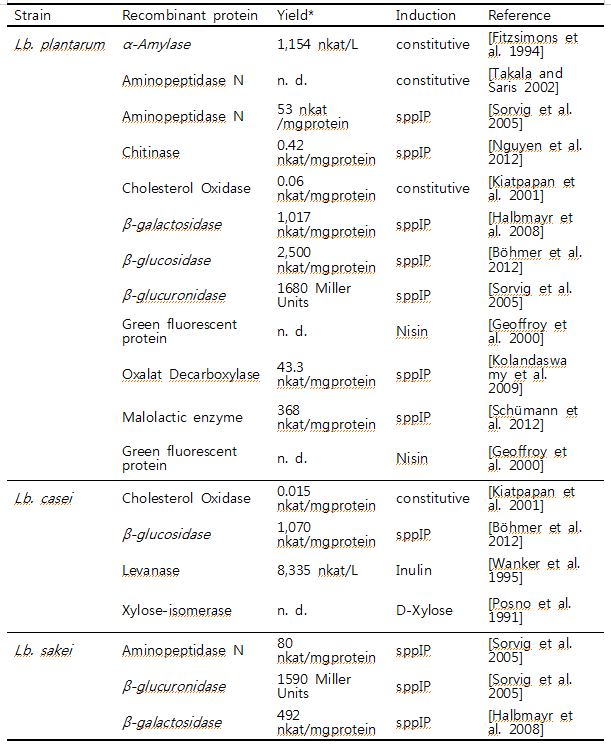
* denoted in nkat in order to make them comparable, if no conversion possible similar to that presented in the original publications
sppIP: sakacin P inducing peptide; inducing peptide of 19 amino acids
Table 2. Lactobacilli which have been used for the recombinant expression of proteins
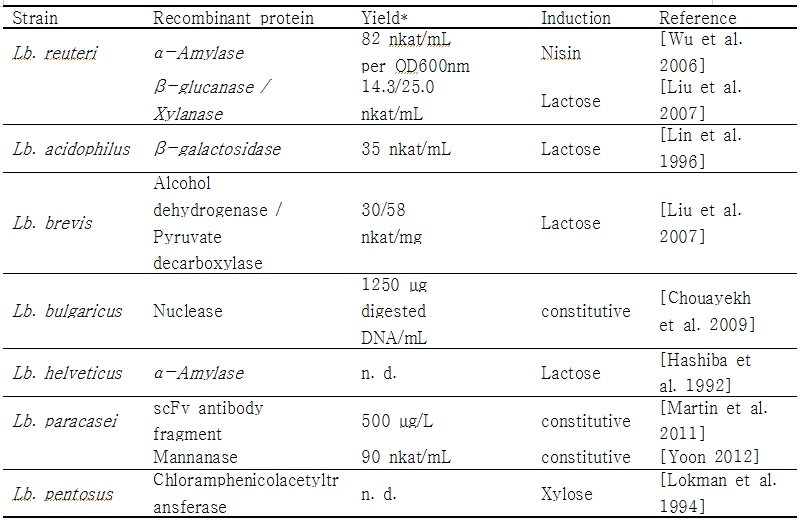
* denoted in nkat in order to make them comparable, if no conversion possible similar to that presented in the original publications
sppIP: sakacin P inducing peptide; inducing peptide of 19 amino acids
4. Integration벡터
Integration벡터는 유전자의 넉아웃 (knock-out), 증폭(amplification), 교체 (replacement) 그리고 삽입 (insertion)에 사용되고 있다. 삽입서열의 전위 (transposition via IS elements) 및 att/integrase systems을 이용하여 특정부위에 재조합, suicide 또는temperature sensitive vectors를 이용한 homologous recombination 방법이 흔히 사용한다 [2]. 유산균 integration벡터시스템은 one-step Campbell-like integration과 one-이나 two-step homologous recombination 두 가지 형태로 구분된다. Campbell-like integration은 integration 동안에 complete vector DNA가 염색체 내부로 삽입되고, 염색체 내부와 같은 위치에 plasmid가 multi-copy integration이 일어나게 된다. one-이나 two-step homologous recombination 기술은 벡터와chromosome 사이에 homologous region이 존재하면 발생할 수 있는데, “one-step gene replacement”가 일어날 때, 동시에 crossover (double crossover)가 일어나고, two-step이 일어날 때는 연속적으로 integration벡터가 loop-out deletion에 의해 integration (single crossover)이 일어나게 된 후 chromosomal deletion이 되거나 integration gene이 염색체 내부로 삽입된다[3].
Campbell-like integration은 Leenhouts에 의해 Lc. lactis에서 복제가 되지 않는 origin을 가지고 있는pBR322 (E.coli)와 pE194 (Staphylococcus aureus)을 이용하여 처음으로 시도되었다. 그 후, pBluescript SK vector의 E.coli replicon 유전자를 이용한 chromosomal integration연구가 진행 되었다 [4, 5]. Lactococcal origin을 이용한 integration벡터는 복제개시단백질(RepA)이 불활성화된 lactococcal broad host range plasmid인 pWV01를 이용하여 개발된 pORI/pINT 벡터 시리즈를 사용한다. 이 벡터는 RepA을 제공하여 그람양성균 (Lc. lactis LL108)뿐만 아니라 그람음성균 (E. coli EC1000)에서 integration 벡터로 이용된다.
Chromosome에 integration된 plasmid는 항생제마커를 이용하여 선발한 후 integration벡터의 lacZ reporter gene을 이용하여 후 loop-out deletion을 할 수가 있다. 이와 같은 방법으로 sucrose-specific enzyme II을 코드하는 scrA유전자와 sucrose-6-phosphate hydrolase을 코드하는 scrB유전자로 구성된 pINT (pWV01 replication origin) integration벡터를 erythromycin 내성 유전자를 교체하여, chromosome안에 target유전자를 Campbell-like integration하여 food-grade system으로 이용한 사례가 있다 [6].
4.1 온도민감형 플라스미드 (Temperature-sensitive plasmids)
염색체 내부로 유전자를 삽입하기 위해 조건/비조건적으로 복제하는 플라스미드의 원리를 이용한 temperature-sensitive 벡터를 이용한다. Integration벡터인 pG+ 시리즈는 조건부 플라스미드로 temperature-sensitive replicon을 가지고 있어, permissive temperaure (예 28℃)에서 그람양성균과 그람음성균에서 복제가 되지만 생장온도를 높이게 되면 (35℃ 이상) 복제개시단백질 (RepA)이 불활성화되어 벡터의 복제와 숙주 염색체 안에 삽입되는 능력을 잃게 된다. RepA+ temperature sensitive helper plasmid인 pVE6007 [7] 와 RepA- vector인 pORI280 [8]는 또 다른 homologous recombination 시스템으로 사용된다. 이들 두개의 플라스미드는 permissive temperature에서는 유지하지만 생장온도가 높아지면 pVE6007 helper plasmid에서는 RepA가 불활성화되고, RepA가 존재하지 않는 pORI280에서는 복제와 chromosome안으로 삽입을 할 수 없게 된다 [2]. Russell and Klaenhammer [9]는 thermophilic lactobacilli의 pWV01 replicon을 기초로 한 temperature-sensitive helper plasmid인 pTRK669를 개발하였고, Neu and Henrich [10]는 thermophilic lactobacilli를 위한 pTN1 vector를 기초로 한 integration 벡터를 개발하였다. 이 플라스미드는 Lb. curvatus의 rolling-circle 플라스미드인 tpLC2에서 유래하여 42℃이하에서 복제 능력을 불활성화 시킨다.
5. 발현벡터-ON/OFF 유도시스템
유산균에서 동형유전자(homologous protein)와 이형유전자(heterologous protein)를 발현하기 위한 발현벡터에는 복제될 유전자의 전사를 조절하기 위해서 적절한 프로모터가 존재한다. 주로 transcription terminator는 복제될 유전자의 downstream에 위치하고 있어 벡터의 유전자 전사를 종결하고 불필요한 전사를 막아주고, Signal sequences는 생성된 단백질을 분비시키기 위해 사용이 되며 생성된 단백질의 정제를 용이하게 하기 위해 일반적으로 His-tag 이나 다른 인공적인 태그를 붙여 사용한다.
만일 발현 벡터의 프로모터 strength가 강하고 유전자 발현이 매우 높으면, 생성된 단백질은 세포질 (cytoplasm)안에 축적되고 생물학적 활성이 없는 inclusion bodies를 생성하게 된다. 또한 몇몇의 단백질의 경우 고농도로 생성이 되면 오히려 세포에 독성을 나타낸다 [1]. 그로 인해 발현수준을 적절히 조절할 수 있는 여러 가지 유도 프로모터 (inducible promoters)가 개발되었다. 유도 프로모터에는 sugar와 NaCl 조절 프로모터, pH의 감소, 온도의 변화와 파아지 감염 프로모터가 있다 [2]. 지금까지는 NICE라 불리는 nisin 유도 프로모터가 유산균 균주에 널리 사용이 되고 있으며 특히 Lc. lactis에 이용되고 있다. Nisin은 nisin cluster에 의해 조절되어 유산균에서 생합성되는 항균성을 가진 펩타이드이고, NICE 시스템은 nisA 프로모터에 의해 유전자를 조절하는 플라스미드로 Lc. lactis의 nisin gene cluster에서 histidine kinase를 코드하는 NisK유전자와 response regulator역할을 하는 NisR유전자로 구성이 되어 두 개의 유전자의 조절에 의해 신호 변화를 준다 [12]. NICE 플라스미드는 nisin을 생성하지 않고 NisR와 NisK 단백질을 생성하는 균주에 도입되어 세포가 생장하는 대수기때 배지에 첨가된 nisin에 의해 nisA 프로모터가 조절 되는데, 발현 수준은 첨가된 nisin양과 비례하고 단백질의 생성 수준은 총 생산 soluble 단백질의 10%에서 60%까지 증가율을 보였다 [12]. Nisin 유도 시스템은 Lc. lactis외의 다른 유산균에서 숙주세포와 유도 효율에 의한 내성으로 인해 nisR와 nisK의 발현 수준에서 문제가 될 수 있으나, nisin은 food-grade물질로 값이 저렴하고 적은 양 (0.05-5 ng/mL)으로도 정확하게 단백질 생산을 on/off로 유도할 수가 있어 생산시스템으로 많은 장점을 가지고 있다. 또 다른 유도 프로모터로 Lb sakei와 Lb. plantarum에서 class Ⅱ bacteriocin sakacin A (sap gene cluster)나 sakacin P (spp gene cluster)의 프로모터와 조절 유전자를 이용한 pSIP벡터가 개발되었고[13, 14], 이 시스템은 pheromone 펩타이드를 첨가하여 단백질 발현을 유도할 수 있다.
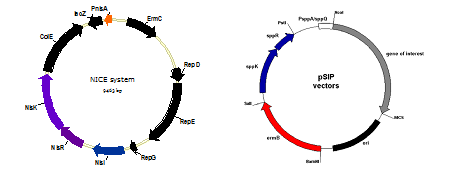
그림1. Schematic overview of the NICE vector and pSIP vector expression system.
PnisA; promoter, NisR and NisK; regulation, NisI; immunity, PsppA or PsppQ; promoter, sppK and sppR; regulation
6. 합성 프로모터 (synthetic promoters)
Jensen and Hammer [15]은 목표유전자 (targeted gene)의 발현수준을 높이고 매우 안정된 발현 시스템을 얻고자 합성프로모터의 라이브러리를 기초로 한 Lc. lactis 발현시스템을 개발하였다. 프로모터 부분의 -35와 -10에 일치하는 염기서열 (consensus sequences)을 일정하게 유지하고 염기 서열간에 일치하지 않는 spacer sequences부분은 랜덤한 염기서열로 대체하였다. 랜덤하게 존재하는 spacer sequences의 프로모터는 degenerated single-stranded promoter oligonucleotide에 의해 합성하였고 이를 β-galactosidase 유전자 (lacL and lacM) 발현에 적용하였다. 합성프로모터는 단백질 발현량을 10-1000배로 다양하게 조절 할 수 있으며 유산균 뿐 만 아니라 다른 미생물에서도 유용하게 적용이 가능하다[16].
표3. Constitutive promoter for the expression in lactic acid bacteria
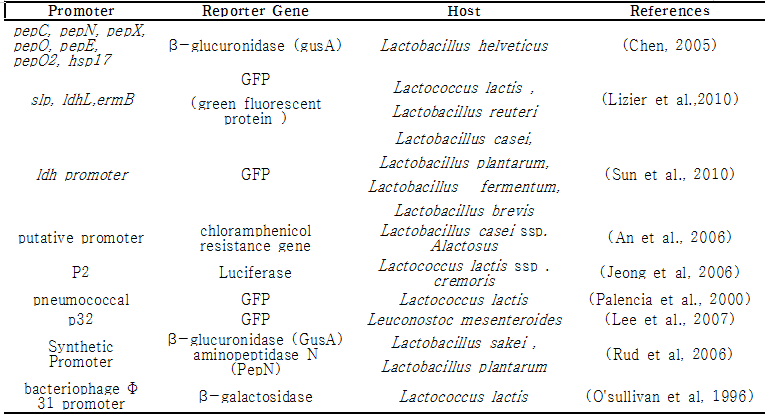
pep; proteolytic enzyme genes, hsp; small heat-shock protein gene, slp; surface layer protein gene, ldh; lactate dehydrogenase gene, erm; enterococcal rRNA adenine N-6-methyltransferase gene
7. Food-grade 선발 표지 (selectable marker)
Food-grade시스템은 숙주안에서 integration과 발현 벡터의 안정성을 기초로 하여, 식품에 사용이 가능한 다양한 선발표지 개발이 필요하다. 무엇보다 항생제 내성 선발표지의 경우 인간장내미생물로 항생제 내성이 전이될 수 있으므로 사용할 수 없으며, 이를 대체하기 위해dominant와 complementation 선발 방법을 이용하여 선발 표지를 개발해 왔다. [17, 18]. 높은 활성을 보이는 dominant선발은 재조합 유산균을 선발함에 있어서 항생제 내성 선발표지의 사용과 같은 효과를 보이며 host의 특정 유전자에 의존하지 않으므로 유산균의 다양한 종에서 이용된다.
Nisin에 내성이 있는 nsr유전자는 hydrophobic 단백질로써, dominant선발에 이용이 된다. pNP40 (60 kb)벡터에 nsr유전자를 도입하여 food-grade 선발표지로 사용되고 있으며 [19], Takala and Saris [20]는 nisin 면역 유전자인 nisI를 이용하여 pLEB590 벡터를 개발하였고, class II bacteriocin lactacin F를 코딩하는 Lb. johnsonii lafI유전자를 이용하여 lactacin F에 민감도를 보이는 균주에 사용가능한 pTRK434/435발현시스템을 개발하였다[21].
Two-component food-grade 클로닝 시스템은 Lc. lactis MG 1363과 산업용 Lc. Lactis 균주에서 사용되고 있는데 [22], 이 시스템은 theta type메커니즘으로 복제가 이루어지며 선발 표지가 없는 pVEC1와, repB유전자가 불활성화되고 erythromycin 내성유전자를 가지고 있는 pCOM1으로 두 가지 벡터로 구성되어 있다. Erythromycin첨가 배지에 pVEC1와 pCOM1 벡터가 같이 복제가 되어야만 생존할 수 있으며, pCOM1와 같은 theta type메커니즘으로 복제하는 벡터는 세포분열과 구조면에서 안정성을 보이기 때문에 선발 후 항생제가 없는 배지에 생장시킬 경우에 pCOM1만을 복제하는 미생물을 선발 할 수 있다.
O´Sullivan [23, 24]는 natural co-integrate lactococcal plasmid pAH90(26kb)을 이용하여 cadmium 내성으로 재조합유산균을 선발하는 방법을 개발하였으며, Strep. thermophilus [25, 26]와 L. lactis [27] 균주에 이용했다. 최근에는 Lb. plantarum 유래의 bile salt hydrolase을 이용한 dominant 선발표지가 개발되어, Lb. casei에서 bsh유전자를 발현시켰을 때, 재조합유산균은 0.1% bile salt (glycodeoxycholic acid sodium, GDCA) 에서 생육이 되지만 wild-type Lb. casei는 0.05% GDCA에서 생장이 저해되어 재조합 유산균을 선발할 수 있다.
Posno [28]은 D-xylose와 같은 당 대사능력을 이용한 dominant 선발방법을 처음으로 개발했다. Lb. pentosus에서 D-xylose를 코드하는 xylRAB 유전자를 이용한 E. coli-Lactobacillus 셔틀벡터는 erythromycin을 첨가한 배지에서 D-xylose를 대사 할 수 있어 food-grade 마커로써 사용이 될 수 있다. 또한, Lactococcus raffinolactis균주에서b-Galactosidase유전자를 이용하여 melibiose 대사할 수 있는 발현벡터를 개발하였다[29].
안정적이고 선택적인 host/vector시스템을 개발하기 위한 또 다른 방법으로는 미생물의 대사경로나 어떤 특성을 부여하는 필수적인 단계에 관련된 chromosome 유전자를 돌연변이 시키는 complementation방법이 이용된다. Complementation을 구축하기 위해서 host chromosome안에 목적유전자를 knock-out한 돌연변이 균주를 선발한 후, 양립할 수 있는 complementation을 도입한 벡터를 구축한다. Dickley[54]는 Purine 생합성 경로에서 nonsense suppressor (ocher suppressor유전자 supB)의 돌연변이를 일으킨 Lc. Lactis를 이용하여 영양요구성 food-grade마커를 도입한 pFG1를 개발하였다. Alanine racemase를 코드하는 alr유전자를 이용한 complementation이 개발되었다. Alanine racemase는 L-alanine과 D-alanine의 상호작용을 촉매하여 세포벽 합성에 관여하여 Lb. plantarum와 Lc. lactis [31] 생장에 필수적으로 필요한 효소로써, Lb. plantarum와 Lc. Lactis의 chromosomal alr유전자 내부의 100bp와 30bp부분을 각각 제거하여 D-alanine 영양요구성 균주를 선발하였고, lactococcal/lactobacillal alr유전자로 구성된 pGIP벡터를 이용된다. 그 외에 다양한 유산균에서 chromosomal lactose operon을 특정적으로 돌연변이를 일으켜서 complementation마커로 이용된다 [32].
8. 유산균에서 food-grade gene expression 사례
Hernández은 [36] strawberry (Fragariax ananassa)유래의 alcohol acyltransferase (SAAT)와 linalool/nerolidol synthase (FaNES)를 코딩하는 두 가지 유전자를 NICE system을 이용하여 발현시켜 fruit flavor metabolites, esters 그리고 terpenoid를 각각 합성할 수 있었고, 면역단백질 생산에 있어서 peanut (Arachis hypogaea) allergen Ara h2을 코딩하는 유전자를 signal sequence (SP310mut2) 와 lactate-inducible lactococcal P170 promotor를 이용하여 Lc. Lactis에서 발현을 수행하였다[37]. 항시발현 Lactococcal P32 promoter와 NICE system을 이용하여 Bacillus subtilis nattokinase 생산을 Lc. lactis에서 연구하여 혈전증(thrombosis)을 예방하거나 조절할 수 있는 물질을 생산하였으며 [38], 그 외로 oral vaccine 및 단백질 delivery 연구가 Lc. lactis에서 진행이 되어 murine cytokine IFN-γ[39, 40], Helicobacter pyloris urease subunit B [41], a hepatitis B virus surface antigen [42], 또는 Listeria monocytogenes antigens P60와 LLO [43]을 생산하였다.
표4. Secretion system for the expression in Lactic acid bacteria
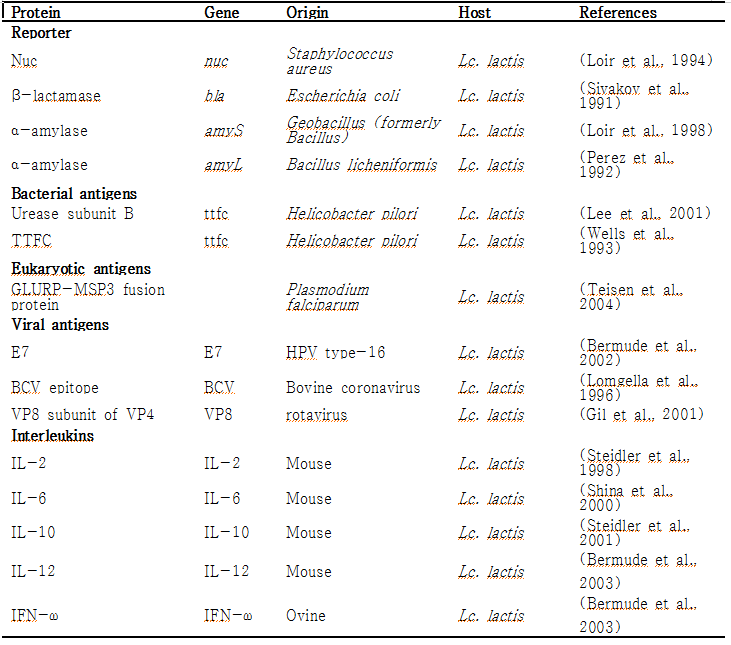
표5. Display system for the expression in Lactic acid bacteria