최신 연구동향
광합성 모방 이산화탄소 전환 및 화학소재 생산 연구동향

한국생명공학연구원
바이오화학연구센터
성봉현 박사
1. 개요
비록 논란은 있지만, 산업혁명 이후 이산화탄소의 대기 중 농도는 275 에서 400ppm으로 높아졌고, 그와 비례해서 지구의 온도도 올라갔다. 이러한 지구 온난화에 따라 대규모 홍수와 가뭄, 한파, 이상 고온 현상 같은 기후 변화가 훨씬 더 심각해졌고, 이를 해결하기 위해서 2005년 전세계는 온실가스 총 배출량을 감축하는 교토의정서를 채택했다. 자국 산업보호 및 국가적 형평성 문제로 미국, 일본, 캐나다 등이 탈퇴하긴 했지만, 유럽 및 호주에서는 탄소시장이 개설, 운영되고 있다. 불경기로 인하여 전년 대비 38%가 감소했지만 전세계 탄소배출권 시장의 94%를 차지하는 EU의 탄소배출권 시장의 규모는 2013년 384억유로(57조원)에 달하며, 중국과 우리나라는 2015년 배출권 거래를 시작한다(1). 정치 및 경제적 이슈에 민감하고, 2020년에 새로운 국가 간 조약이 설정되기 때문에, 탄소시장의 미래는 불확실하다. 하지만, 우리나라는 년간 약 6억톤의 이산화탄소를 배출하는 세계 7위권 국가이며, 산업의 구조적 특성 때문에 다른 나라에 비해 1인당 탄소배출량이 많아, 이산화탄소를 줄이고자 하는 전세계적인 노력에 더욱 신경 써야 한다. 즉 앞으로 정도의 차이는 있겠지만, 이산화탄소 자체가 돈이 되는 시대가 도래한 것은 분명하다.
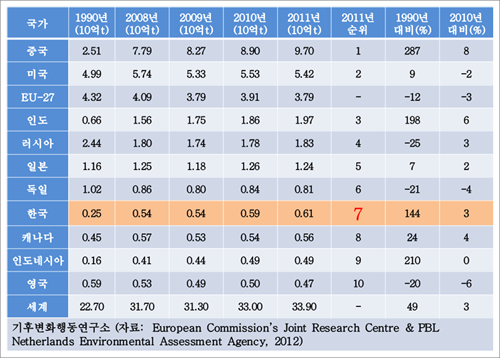
그림 1. 국가별 이산화탄소 배출량(2)
감축에 따른 경제적 이득에 덧붙여, 이산화탄소를 활용해서 청정수송연료, 메탄올, 플라스틱, 의약, 시멘트 등과 같은 광범위의 바이오화학 소재를 생산할 수 있는 기술이 발달함에 따라(3), 이산화탄소는 단순히 쓸모없는 산업 폐기물이 아니라 중요한 산업원료로 인식되기 시작했다. 이에 따라 이산화탄소를 줄이는 방법이 CCS(carbon capture and storage)의 관점에서 CCU (carbon capture and utilization)로 바뀌고 있다. 특히 이산화탄소를 제거하고 산소, 유기물을 생성하는 광합성을 모방한 인공광합성을 통해 이산화탄소를 고부가 화학소재로 전환하는 기술은 가장 친환경적인 미래 기술로 부각되고 있다.
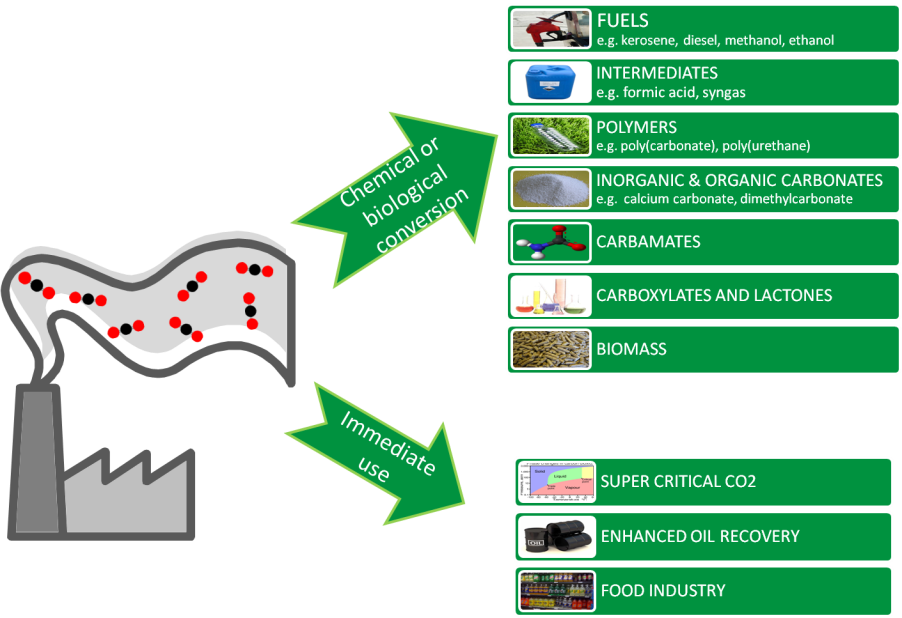
그림 2. 이산화탄소의 활용 방안(3)
2010년 미국에서는 로렌스 버클리 국립연구소와 캘리포니아 공대를 중심으로 인공광합성공동연구센터(Joint Center for Artificial Photosynthesis)를 설립하였다. 이는 미국에서 가장 큰 연구프로그램으로 2020년 상용화를 목표로 인공 태양광-연료 생산기술(이산화탄소, 햇빛, 물 만으로 화학소재, 연료를 생산하는 경제적인 방법)을 개발 중이다(4). 또한 2011년 연두교서에서 미국의 오바마 대통령은 청정 에너지 분야에 대한 2011년판 아폴로 계획을 제시하며 인공광합성을 통해 이산화탄소를 화학소재 및 연료로 전환하는 기술을 첫 번째로 언급하며 강조했다(5).
독일 정부의 지원 하에 세계 최대 화학기업 BASF를 중심으로 대학과 전력기업 등은 광촉매 과정을 통해 태양에너지로 이산화탄소를 물과 반응시켜 메탄올을 생산하는 ‘Solar2Fuel’ 프로젝트를 추진하고 있다(6). 일본의 미쯔이케미컬 또한 경제산업성(METI) 산하 지구환경산업기술연구소(RITE, Research Institute of Technology for Earth)와 공동연구를 통해 자체 석유화학 플랜트에서 배출되는 이산화탄소를 포집하여 수소와 반응시켜 메탄올을 생산하는 기술을 확보했으며, 현재 대량의 수소를 확보하기 위해 인공광합성 기술을 개발 중에 있다(5). 2011년 일본 도요타 중앙 연구소(7) 및 2012년 Panasonic에서는 질화물 반도체를 활용한 인공광합성 시스템을 이용해서 0.2%의 효율로 이산화탄소에서 formic acid로 전환하는 기술을 개발했다(8). 이처럼 선진국에서는 범정부 차원에서 지원하는 가운데 화학 기업들을 중심으로 이산화탄소를 전환하는 연구 및 사업화가 확대되고 있다(5).
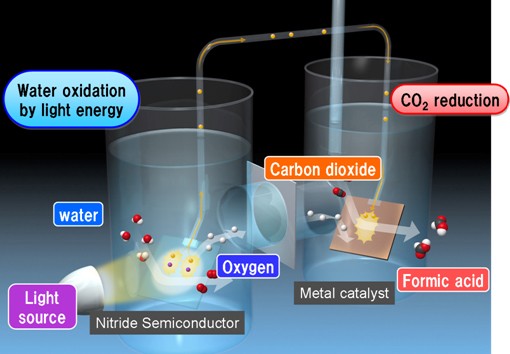
그림 3. 파나소닉의 인공광합성 모식도
2. 인공광합성, 광합성의 모방
광합성은 명반응과 암반응으로 나눌 수 있다. 명반응은 엽록체의 틸라코이드 막에서 일어나는데, 전자공여자인 물이 빛에 의해 산소와 수소이온으로 분해되면서 전자를 방출한다. 이 전자는 여러 전자 수용체들을 거쳐 photosystem II에서 ATP를 생성하고, photosystem I에서 다시 빛 에너지를 통해 NADPH를 생성한다. 암반응에서는 Calvin 회로를 통해 명반응에서 만들어진 ATP, NADPH를 사용하여 이산화탄소가 유기물로 환원된다.
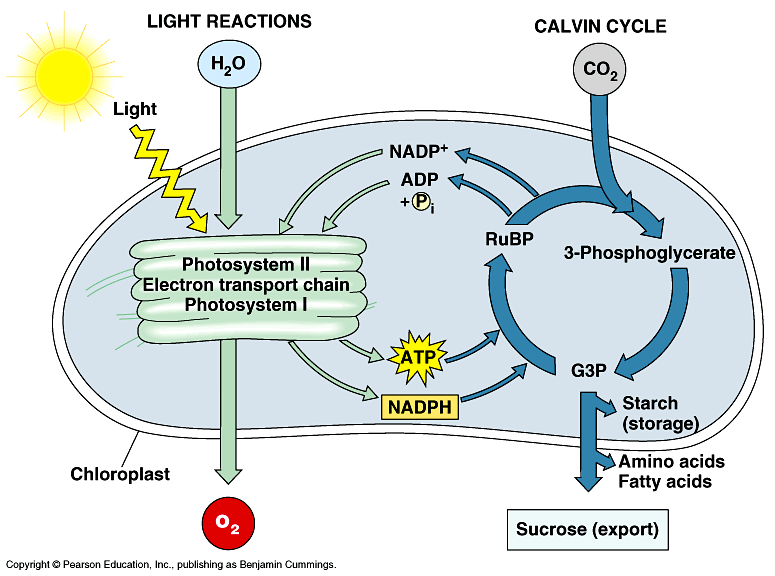
그림 4. 광합성의 명반응과 암반응 (9)
인공광합성은 자연계의 광합성 메커니즘을 모방한 시스템이다(10). 따라서 인공광합성에도 명반응과 암반응이 존재하는데, 현재 대부분의 연구는 광합성의 명반응을 모방하는 것에 집중되어 있다(11). 이 부분에 대해서는 다른 연구자 분께서 추후에 잘 설명해 주실 것이므로 그 중에서 몇 가지만 아주 간략히 보면, 나노구조의 광촉매를 활용한 광전기 화학 전지(photoelectrochemical cell)에 대한 연구를 통해 빛으로 물을 분해해 수소생산에 활용하거나 (12-14), 염료감응 태양전지의 광전극을 이용해 cofactor를 재생하고 산화환원용 효소반응을 유도하였다(15), 또한 암반응을 모방해 물분해에서 얻어진 수소와 이산화탄소를 금속촉매로 반응시켜 메탄올로 전환하는 연구가 수행되었고(16,17), 나뭇잎 구조와 유사한 인공나뭇잎을 개발하는 연구가 진행되었다(18,19). 이러한 과정은 외부로부터의 추가적 에너지 투입 없이 태양에너지와 물, 이산화탄소만으로 이루어질 수 있다는 점에서 가장 친환경적인 미래 기술로 부각되고 있다. 현재의 인공광합성 연구는 광범위한 전체 광합성 연구보다는, 다양한 학문분야에서 한정적으로 광합성을 모방하고 있는 기초단계이지만(11), 머지않아 각 분야 연구가 융합되어 포괄적인 인공광합성 시스템이 완성될 날이 올 것이다.
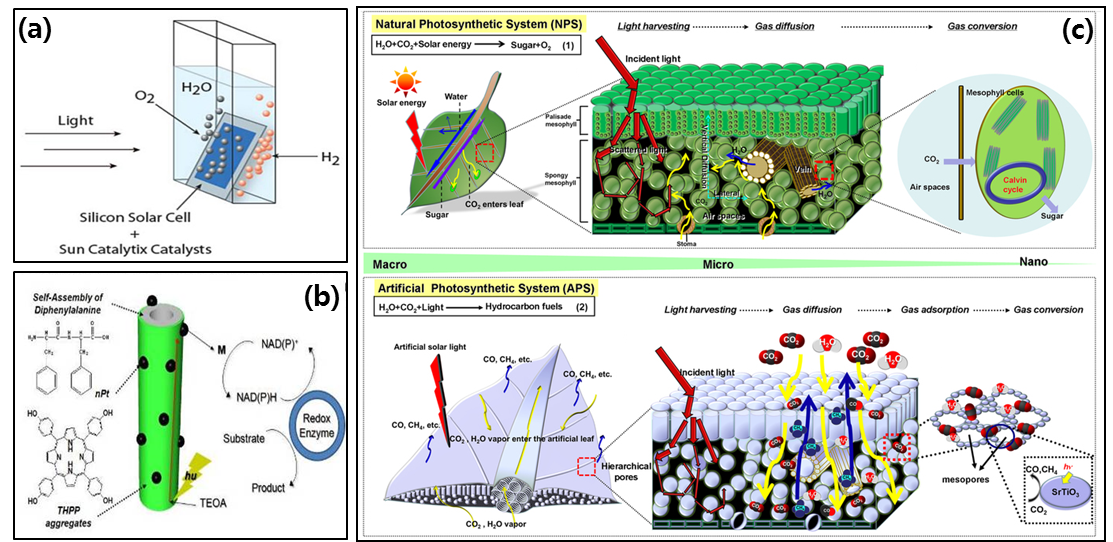
그림 5. 광합성을 모사한 인공광합성에 관한 연구들. (a) 촉매를 활용한 빛에 의한 물 분해 (b) 광촉매와 효소를 활용한 cofactor 재생 (c) 나뭇잎을 모사한 인공 나뭇잎의 3차 구조 구축
3. 광합성 미생물을 이용한 바이오화학 소재 생산
인공광합성 연구의 경우 개념정립단계로 실제 사업화가 이루어지기에는 아직 많은 시간이필요하다. 이산화탄소를 전환하여 바이오화학소재를 경제적으로 생산하기 위해 광합성을 모방하는 것이 아니라, 광합성 자체를 개선하는 연구도 수행되고 있다. 자연계에는 이미 수천만 년 동안 미생물에서 광합성을 통해 물과 이산화탄소로 포도당을 만드는 탄소 사이클(Carbon Cycle)이 존재해 왔다. 조작하기가 힘들어 단순배양하는 수준에 머물렀던 연구가, 최근 들어 유전공학, 대사공학, 합성생물학 기술이 발전함에 따라 외부 유전자를 도입하여 식물, 남세균(cyanobacteria)나 자색세균(purple photosynthetic bacteria)의 광합성 시스템을 이용, 다양한 바이오연료/화학소재를 생산하게 되었다(20-22). 이 경우, Calvin-Benson-Bassham 경로를 통해 이산화탄소가 pyruvate를 거쳐 바이오 화학소재가 형성이 되므로, 제품의 생산성 증가를 위해 carboxysome의 발현을 높이거나 루비스코 유전자의 과발현을 통해서 이산화탄소의 고정 효율을 증가하는 연구가 수행되었다(23-25).
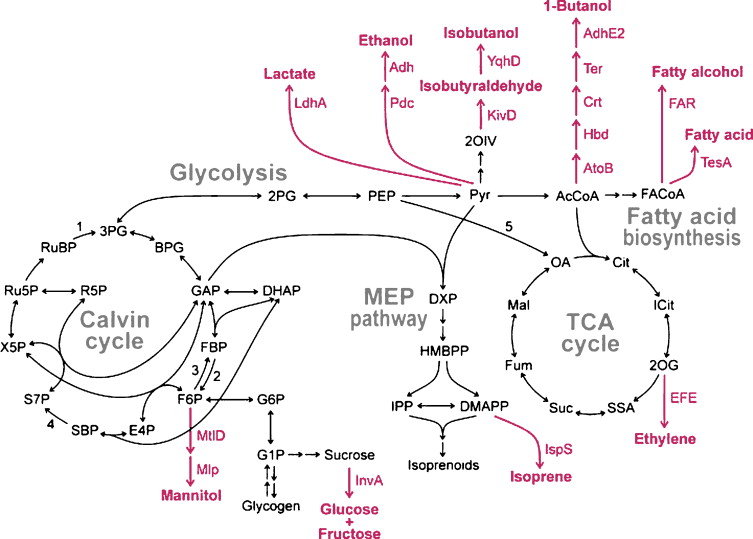
그림6. 남세균의 바이오화학소재 생산 핵심 대사경로(25)
인공대사경로 도입, 대사조절, 성장조건 조작과 같은 방법을 통해 광합성 세균에서 바이오연료, 에너지, 플라스틱, 항산화제 등을 생산할 수 있었지만, 아래 표 1에서 보듯이 산업적으로 활용하기에는 아직 미흡하다. 그렇지만 많은 연구자들에 의해서 꾸준히 연구되고 있으므로 멀지 않은 미래에 다양한 기술의 발달로 원하는 수준의 제품 생산 수율 증대를 이룰 수 있을 것이다.
표 1. 광합성 미생물을 활용한 바이오화학소재 생산성
|
화학소재 |
생산성(mg/L/h) |
참고문헌 |
|
2,3-butanediol |
9,847 |
(26) |
|
Isobutyraldehyde |
6,230 |
(24) |
|
Fatty acid |
4,104 |
(27) |
|
Ethanol |
3,972 |
(28) |
|
Isobutanol |
3,125 |
(24) |
|
Ethylene |
3,100 |
(29) |
|
Lactic acid |
625 |
(30) |
|
Acetone |
375 |
(31) |
|
Butnaol |
79.2 |
(32) |
|
Fatty alcohol |
0.5 |
(33) |
|
Isoprene |
2.08 mg/gDCW/h |
(34) |
4. 미생물 전기생합성 (microbial electrosynthesis)을 이용한 화학소재 생산
미생물 전기생합성은 Geobacter나 일부 Acetogen 미생물이 전기를 이용하여 이산화탄소를 환원하고 acetyl-CoA를 비롯한 대사중간체를 생합성 하는 것이다. 이러한 미생물들은 Wood-Ljungdahl pathway 라는 환원 아세틸-CoA 경로(reductive acetyl-CoA pathway)에서 수소를 전자공여자로 이산화탄소를 전자수용자로 이용한다. 이 대사경로에서 이산화탄소는 일산화탄소로 환원되고, 궁극적으로는 아세틸-CoA로 전환된다. 최근 개념이 제안되어(35) 가능성이 검증되고 있다(36,37). 전극에 부착되어 자라는 Sporomusa ovate의 생물막(biofilm)에서 전자를 소비하여 초산과 소량의 2-oxobutyrate가 생성되는 것을 확인할 수 있었으며, Shewanella oneidensis에 대장균의 글리세롤 활용 유전자들과 Zymomonas의 에탄올 생산 유전자 모듈을 넣었을 때, 세포 내 산화환원 균형이 맞지 않는 조건에서도 에탄올발효가 가능하게 되었다. 최근 in silico 대사경로 재구축 기법을 이용하여 대장균에서 전기생합성을 이용하면 NADH 재생으로 인하여 세포 내 산화 환원 균형을 조절할 수 있어 n-butanol, 1,4-butandiol, succinate, ethanol, 1,3-propanediol과 같은 다양한 바이오화학소재의 생산률을 증가시킬 수 있다는 제안과 이러한 모델 시스템의 장단점에 대한 전체적인 이해 방법이 제시되었다(38). 전기생합성 역시 기존의 인공광합성과 비슷하게 개념정립단계에 있는 연구로 이산화탄소를 환원시켜 유용한 바이오화학소재를 생산할 수 있지만, 아직 많은 연구가 수행되어야 한다. 전기생합성의 역반응인 미생물 연료전지 분야는 많은 연구가 이루어져 있으므로, 곧 많은 발전이 있을 것으로 예상된다.
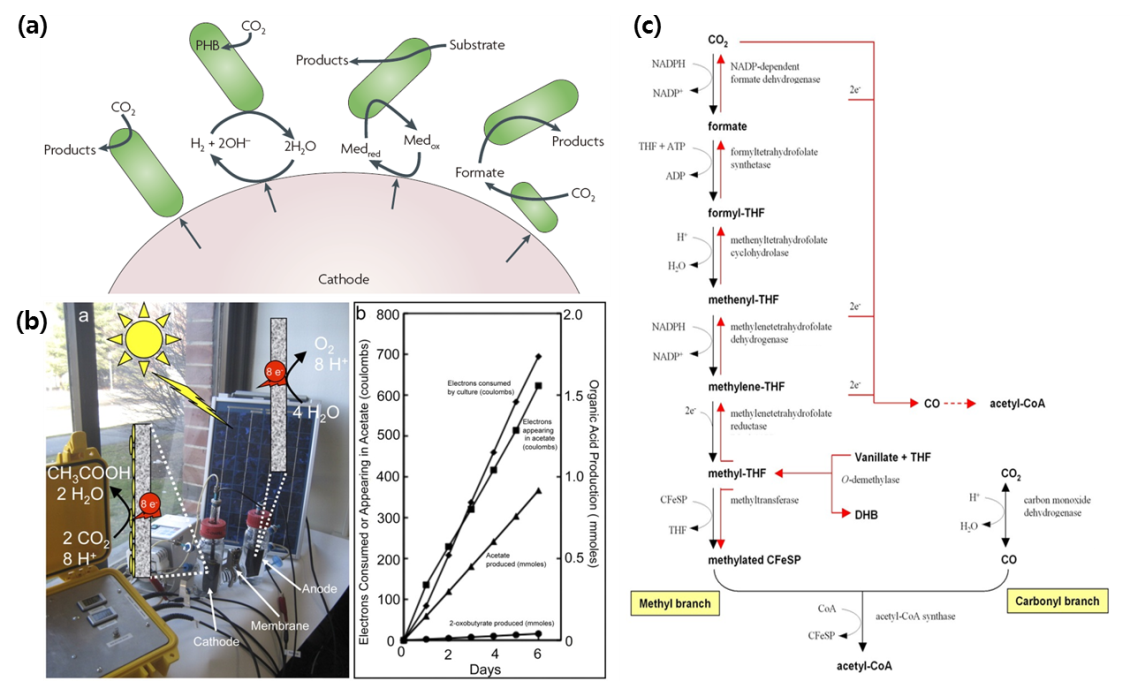
그림 7. 미생물 전기생합성에서 전극과 미생물 간의 전자 전달 메커니즘(a), 이를 이용한 유기산 생성(b), 그리고, 이산화탄소 고정에 작용하는 Wood-Ljungdahl pathway (c)
5. 고찰
앞서 본 바와 같이, 광합성을 모방한 이산화탄소의 전환/활용 연구는 산업적으로 활용하기에는 아직 미흡하다. 앞으로 촉매, 광학, 바이오 등의 다양한 기술 개발 연구가 많이 수행되어야 하지만, 환경문제 해결과 함께 새로운 수익을 창출할 수 있다는 점에서 많은 국가와 기업들이 관심을 보이고 있다. 미국 DOE, 로렌스 버클리 국립연구소에서는 에너지 효율향상, 신재생 에너지 활용, CCU, 인공광합성 등으로 이산화탄소의 균형이 조절되는 미래의 모습을 ‘Carbon Cycle 2.0’이라고 그리고 있다(39). Carbon Cycle 2.0을 이루기 위해서는 이산화탄소를 적극적으로 줄일 수 있는 광합성 모방 이산화탄소 환원 및 화학소재 생산 연구가 무엇보다 중요하다. 거대 화학기업들이 미래 환경규제 강화에 대응하여 인공광합성을 통한 바이오화학소재 생산에 주목하고, 다양한 협력을 통한 효과적인 비즈니스 모델을 구축하기 위해 노력하고 있으므로, 우리도 이에 뒤지지 않고 앞서 나가기 위해 우리의 역량을 집결해야 할 것이다.

그림 8. Carbon cycle 2.0 Diagram
6. 참고문헌
1. 조용권. (2013) 탄소시장의 3대 이슈와 전망. SERI 경제 포커스
2. http://climateaction.re.kr/index.php?document_srl=28178&mid=news01.
3. http://co2chem.co.uk/background/about-cdu.
4. http://solarfuelshub.org/index.html.
5. 문상철. (2011) 이산화탄소를 재활용하는 CCU 기술의 개발이 빨라지고 있다. LG Business Insight, 28-35
6. http://www.photonikforschung.de/fileadmin/Verbundsteckbriefe/13._Spitzencluster/Projektsteckbrief_Solar2Fuel2-korr10.2012.pdf.
7. http://www.tytlabs.com/cms/news/pdf/press/20110920_epress.pdf.
8. http://newenergyandfuel.com/http:/newenergyandfuel/com/2012/08/01/a-big-jump-ahead-for-artificial-photosynthesis/.
9. http://www.skepticalscience.com/co2-plant-food.htm.
10. Barber, J., and Tran, P. D. (2013) From natural to artificial photosynthesis. Journal of the Royal Society, Interface / the Royal Society 10, 20120984
11. http://times.kaist.ac.kr/news/articleView.html?idxno=2527.
12. Pijpers, J. J., Winkler, M. T., Surendranath, Y., Buonassisi, T., and Nocera, D. G. (2011) Light-induced water oxidation at silicon electrodes functionalized with a cobalt oxygen-evolving catalyst. Proceedings of the National Academy of Sciences of the United States of America 108, 10056-10061
13. Reece, S. Y., Hamel, J. A., Sung, K., Jarvi, T. D., Esswein, A. J., Pijpers, J. J., and Nocera, D. G. (2011) Wireless solar water splitting using silicon-based semiconductors and earth-abundant catalysts. Science 334, 645-648
14. Ronge, J., Bosserez, T., MArtel, D., Nervi, C., Boarino, L., Taulelle, F., Dcher, G., Bordiga, S., and A., M. J. (2013) Monolithic cells for solar fuels. Chem Soc Rev, DOI: 10.1039/c1033cs60424a
15. Kim, J. H., Lee, M., Lee, J. S., and Park, C. B. (2012) Self-assembled light-harvesting peptide nanotubes for mimicking natural photosynthesis. Angewandte Chemie 51, 517-520
16. Studt, F., Sharafutdinov, I., Abild-Pedersen, F., Elkjaer, C. F., Hummelshoj, J. S., Dahl, S., Chorkendorff, I., and Norskov, J. K. (2014) Discovery of a Ni-Ga catalyst for carbon dioxide reduction to methanol. Nature chemistry 6, 320-324
17. Riduan, S. N., Zhang, Y., and Ying, J. Y. (2009) Conversion of carbon dioxide into methanol with silanes over N-heterocyclic carbene catalysts. Angewandte Chemie 48, 3322-3325
18. http://www.bae.ncsu.edu/topic/bioenergy-bioproduct/bebp/Sub_Pages/Research/ongoing_projects.html#.
19. Zhou, H., Guo, J., Li, P., Fan, T., Zhang, D., and Ye, J. (2013) Leaf-architectured 3D hierarchical artificial photosynthetic system of perovskite titanates towards CO(2) photoreduction into hydrocarbon fuels. Scientific reports 3, 1667
20. Desai, S. H., and Atsumi, S. (2013) Photosynthetic approaches to chemical biotechnology. Current opinion in biotechnology 24, 1031-1036
21. Ducat, D. C., and Silver, P. A. (2012) Improving carbon fixation pathways. Current opinion in chemical biology 16, 337-344
22. Peterhansel, C., and Offermann, S. (2012) Re-engineering of carbon fixation in plants - challenges for plant biotechnology to improve yields in a high-CO2 world. Current opinion in biotechnology 23, 204-208
23. Savage, D. F., Afonso, B., Chen, A. H., and Silver, P. A. (2010) Spatially ordered dynamics of the bacterial carbon fixation machinery. Science 327, 1258-1261
24. Atsumi, S., Higashide, W., and Liao, J. C. (2009) Direct photosynthetic recycling of carbon dioxide to isobutyraldehyde. Nature biotechnology 27, 1177-1180
25. Rosgaard, L., de Porcellinis, A. J., Jacobsen, J. H., Frigaard, N. U., and Sakuragi, Y. (2012) Bioengineering of carbon fixation, biofuels, and biochemicals in cyanobacteria and plants. Journal of biotechnology 162, 134-147
26. Oliver, J. W., Machado, I. M., Yoneda, H., and Atsumi, S. (2013) Cyanobacterial conversion of carbon dioxide to 2,3-butanediol. Proceedings of the National Academy of Sciences of the United States of America 110, 1249-1254
27. Liu, X., Sheng, J., and Curtiss, R., 3rd. (2011) Fatty acid production in genetically modified cyanobacteria. Proceedings of the National Academy of Sciences of the United States of America 108, 6899-6904
28. Dexter, J., and Fu, P. C. (2009) Metabiolic engineering of cyanobacteria for ethanol production. Energy Environ Sci 2, 857-864
29. Ungerer, J., Tao, L., Davis, M., Ghirardi, M., Maness, P. C., and Yu, J. P. (2012) Sustained photosynthetic conversion of CO2 to ethylene in recombinant cyanobacterium Synechocystis 6803. Energy Environ Sci 5, 8998-9006
30. Niederholtmeyer, H., Wolfstadter, B. T., Savage, D. F., Silver, P. A., and Way, J. C. (2010) Engineering cyanobacteria to synthesize and export hydrophilic products. Applied and environmental microbiology 76, 3462-3466
31. Zhou, J., Zhang, H., Zhang, Y., Li, Y., and Ma, Y. (2012) Designing and creating a modularized synthetic pathway in cyanobacterium Synechocystis enables production of acetone from carbon dioxide. Metabolic engineering 14, 394-400
32. Lan, E. I., and Liao, J. C. (2012) ATP drives direct photosynthetic production of 1-butanol in cyanobacteria. Proceedings of the National Academy of Sciences of the United States of America 109, 6018-6023
33. Tan, X., Yao, L., Gao, Q., Wang, W., Qi, F., and Lu, X. (2011) Photosynthesis driven conversion of carbon dioxide to fatty alcohols and hydrocarbons in cyanobacteria. Metabolic engineering 13, 169-176
34. Lindberg, P., Park, S., and Melis, A. (2010) Engineering a platform for photosynthetic isoprene production in cyanobacteria, using Synechocystis as the model organism. Metabolic engineering 12, 70-79
35. Rabaey, K., and Rozendal, R. A. (2010) Microbial electrosynthesis - revisiting the electrical route for microbial production. Nature reviews. Microbiology 8, 706-716
36. Nevin, K. P., Woodard, T. L., Franks, A. E., Summers, Z. M., and Lovley, D. R. (2010) Microbial electrosynthesis: feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds. mBio 1
37. Flynn, J. M., Ross, D. E., Hunt, K. A., Bond, D. R., and Gralnick, J. A. (2010) Enabling unbalanced fermentations by using engineered electrode-interfaced bacteria. mBio 1
38. Pandit, A. V., and Mahadevan, R. (2011) In silico characterization of microbial electrosynthesis for metabolic engineering of biochemicals. Microbial cell factories 10, 76
39. http://carboncycle2.lbl.gov/.





