자가면역세포 조절을 통한 간질환 치료기법 개발

한국과학기술원 정원일 교수
1. 개요
오늘날, 여러 가지 원인들에 의한 간염 및 간경변증에 대하여 약물치료가 이루어지고 있으며 약물치료가 어려운 경우 근치적 간이식이 시행되고 있다. 그러나 약물에 대한 치료저항성이나 간이식 공여자의 부족으로 인한 새로운 치료법의 필요성이 대두되고 있다. 선행된 동물실험 모델에서, 사염화탄소로 유도된 간경변증이 있는 마우스에 골수세포 주입 후, 혈청학적, 조직학적 손상이 현저하게 감소할 뿐만 아니라 생존율을 증가시켰다는 보고가 있었다 (Sakaida, et al., 2004). 이러한 결과는 주입한 골수유래 세포가 이식 마우스 간내로 이동한 후, 사염화탄소로 손상받은 간에서 기능적 간세포로 직접 분화하여 재구성됨으로써 이와 같은 효과를 나타낸다고 생각할 수 있다(Kuo, et al., 2008). 뿐만 아니라, 임상 보고에서도 동물실험과 유사하게 알코올성, 괴사후성, 자가면역성 간질환 환자들에게 자신의 골수세포(whole bone marrow cells)를 이식하여 간기능의 개선, 간 증식표지의 증가 및 삶의 질 향상 등의 긍정적인 결과들이 보고되었다 (Park, et al., 2013, Spahr, et al., 2013, Amin, et al., 2013). 이처럼 간재생 치료분야에서 간경변증에 대한 골수세포 치료는 상당히 매력적인 치료방법이지만 대다수의 연구에서 자가 골수세포 주입의 효과와 안전성에 주목하였을 뿐, 아직까지 골수세포 내 어떤 세포가 간경변증을 완화시키는지에 대해서는 명확히 밝혀져 있지 않고 있다. 따라서 본 보고에서는 간경변증의 기전에 대하여 간단히 살펴보고, 골수세포에 어떤 특성을 갖는 세포들이 존재하여 간경변증을 완화시키는지 그 기전에 대해 자세히 살펴보고자 한다.
2. 간경변증 (Liver cirrhosis)의 기전
간경변증(cirrhosis)은 간섬유화(fibrosis)의 중심이 되는 원인 세포로 알려진 간성상세포(hepatic stellate cells)의 활성으로 인해 분비되는 과도한 세포외 기질(extracellular matrix; ECM)의 축적에 의해 일어난다고 알려져 있다 (Hernandez-Gea V, et al., 2011). 일반적으로 간성상세포는 간세포와 동양내피세포(sinusoidal endothelial cells) 사이 디세강(Space of Disse)에 위치하여 있다(Friedman SL, 2008). 정상상태에서 휴지기의 간성상세포는 세포질 내에 레티놀(Vitamin A)을 다량 함유하고 있는 지방구들을 가지고 있지만 활성화가 되면 레티놀 지방구들을 잃어버리고 근섬유아세포(myofibroblast-like cell)와 같은 모양으로 변하면서 많은 양의 콜라겐 섬유들을 분비하고 α-smooth muscle actin를 발현함으로써 간섬유화를 초래하게 된다(그림 1). 간 손상이 이루어지면서, 간성상세포는 transforming growth factor-β1(TGF-β1), 인터류킨(interleukin)-6(IL-6) 및 monocyte chemoattractant protein-1(MCP-1)과 같은 사이토카인 등을 분비하며 간내 면역세포들을 활성화시킴으로써 간섬유화를 더욱 촉진시킨다(Thompson K, et al., 1998, Radaeva S, et al., 2007). 대표적으로 활성화된 간성상세포들은 직접 간내 항원제시세포로서 기능을 하여 간내 T 세포, 자연살해세포(NK cells), 자연살해 T 세포(NK T cells) 등 간손상과 관련된 여러 염증세포들을 활성화시키는데 관여 하기도 한다(Winau, et al., 2007, Radaeva S, et al., 2006). 결과적으로 간섬유화에 중요한 역할을 하는 간성상세포의 활성억제 및 사멸이 간경변을 호전시키는데 가장 중요한 타겟으로 여겨지고 있다.
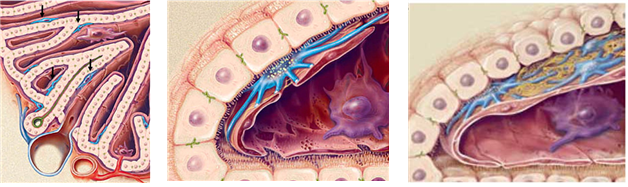
그림 1. 간동양혈관내 위치하고 있는 간성상세포들(화살표; 푸른색)은 휴지기 레티놀을 가지고 있으나 간손상이 시작되면 증식과 동시에 많은 세포외기질을 분비하여 간섬유화를 유도함(Physiol Rev. 2008 Jan;88(1):125-72).
3. 자가골수세포(autologous bone marrwo cell)를 이용한 간 질환치료 연구
지난 수십 년간 임상적 혹은 실험적 연구보고에 의하면 자가골수세포 주입술 (infusion therapy of autologous bone marrow cell)은 간재생, 간손상 및 간경변증에 효과적으로 알려져 왔었다. 주로 주입된 골수세포들이 간세포로 직접 분화를 하거나, 간전구세포들(progenitor cell)의 증식유도 및 간내 축적된 세포외기질(ECM)을 분해시킴으로 간 질환에 보호 작용을 하는 것으로 알려져 왔다(Petersen et al., 1999, Sakaida I et al., 2004, Terai S et al., 2006). 그러나 골수 내에 존재하는 세포들의 다양성으로 인하여 어떤 세포들이 이러한 작용들을 하는지에 대한 기전이 아직까지 불분명한 상태이다.
최근 연구들에 의하면 간섬유화의 주요세포인 간성상세포들이 콜라겐과 같은 세포외기질(ECM) 분비 기능이외에 면역세포들과의 상호작용에 관한 보고가 많이 되어오고 있고, 예를 들면 T 세포와 NK 세포들을 활성화시키거나 CD11b+Gr1+ 골수유래억제세포 (myeloid-derived suppressor cell; MDSC) 및 CD4+CD25+Foxp3+ regulatory T 세포(Treg)들의 유도에 관여를 하고 있다는 것이 보고가 되었다. 따라서 주입된 자가골수세포들 중 특정 골수세포들이 간성상세포와 상호작용을 통해서 간섬유화가 완화될 수 있다는 가설이 성립하게 된다.
4. 자가골수세포를 이용한 간 질환 치료기전
골수 내에 존재하는 세포들은 다양한 줄기세포(stem cell) 군들과 단핵구계열(monocytic) 및 과립구계열(granulocytic)의 전구세포들로 이루어져 있다(Biermann H, et al., 1999). 특히 우리가 주목하는 세포들은 골수 내에 존재하는 골수유래억제세포들(MDSC)로 주로 골수전구세포들(myeloid progenitor cells)과 미성숙 골수세포들(immature myeloid cells)로 이루어져 있다. 골수유래억제세포들(MDSC)의 경우 그림 2와 같이 Gr1과 CD11b를 발현하는 세포들로써 주로 암환자들에서 염증세포들(특히 항암세포들)을 억제하는 기능을 하며, 이들 세포들은 다시 크게 2가지 주요 그룹으로 구분되는데, CD11b+Ly6G+Ly6Clow granulocytic MDSC와 CD11b+Ly6G-Ly6Chigh monocytic MDSC으로 나눠진다(Gabrilovich DI and Nagaraj S, 2009, Youn JI, et al., 2010).
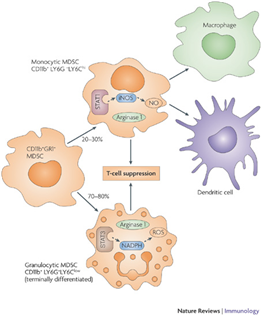
그림 2. 다른 형태의 MDSC들과 이들 세포들의 T 세포 억제기전(Nat Rev Immunol. 2009 Mar;9(3):162-74).
이들 골수유래억제세포들(MDSC)의 전형적인 특징은 arginase-1, iNOS 및 ROS를 분비함으로 인해 T세포와 같은 면역세포들에 대한 억제기능을 갖는다는 것이다(Ostrand-Rosenberg S, et al., 2010, Gabrilovich DI, et al., 2009). 또한 염증을 억제시키는 Treg세포들의 유도에도 관여를 하여 TGF-β1과 인터류킨-10(IL-10)의 분비를 촉진시키며, 이렇게 분비된 인터류킨-10은 항염증작용 뿐만 아니라 특이적으로 간성상세포들의 활성억제에도 관여를 하고 있다고 알려져 있다(Hernandez-Gea et al., 2011, Thompson K et al., 1998). 이러한 보고들을 종합하여 볼 때, 우리는 골수내 존재하는 MDSC 유사 세포들이 간내로 이동하여 간성상세포와 상호작용을 한 후 인터류킨-10을 분비하여 간성상세포의 활성을 억제할 것이라는 가설을 세우고 연구를 실시하였다.
그림 3A에서와 같이 주입된 골수세포들(녹색형광)은 특이적으로 활성화된 간성상세포들(붉은색) 주위에서만 관찰이 되며 주입 후 24시간 내에 간섬유화가 호전(그림 3B; 콜라겐 침착이 현저히 저하)되는 것이 관찰되었다. 또한 간내 염증을 억제하는 Treg의 분포가 현저하게 증가하였으며(그림 3C) 증가된 Treg으로 인하여 MCP-1이나 인터류킨-6와 같은 염증성 사이토카인의 발현은 감소되었으며, 이와 연동되어 간내 염증성 대식구들의 분포도 24시간째에 유의하게 감소하였다(Suh YG, et al., 2012). 다음으로는 주입된 골수세포들 분석에서 Treg과 유사하게 염증을 억제하는 인터류킨-10이 강하게 분비되고 있는 것이 관찰되었으며 이들은 각각 CD11b+Gr1highF4/80-와 CD11b+Gr1+F4/80+ 세포들로 밝혀졌으며 흥미롭게도 CD11b+Gr1highF4/80- 세포들은 granulocytic MDSC와 CD11b+Gr1+F4/80+ 세포들은 monocytic MDSC와 같은 형태의 세포들로 밝혀졌다(그림 4).
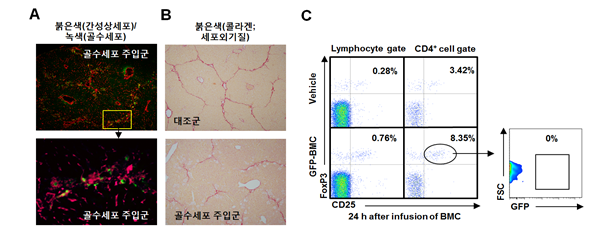
그림 3. 골수세포들의 간성상세포와의 상호작용 및 Treg의 분포 증가로 인한 항섬유화 기능
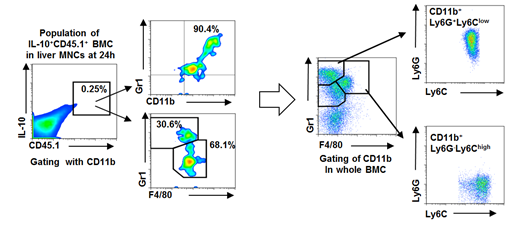
그림 4. 주입된 골수세포들의 인터류킨-10의 발현과 MDSC와 유사한 마커를 발현함.
이러한 기전은 in vitro 세포수준 실험에서도 증명되었는데, 마우스의 골수세포와 마우스 간성상세포들(그림 5A) 그리고 인간 골수세포(그림 5B)들과 인간 간성상세포주(LX-2 및 hTERT)들과의 공동배양에서도 골수세포들의 인터류킨-10의 발현이 현저하게 증가되었고, 이들 골수세포들의 인터류킨-10의 발현 정도는 간성상세포들이 분비하는 레티노익산(retinoic acid)에 의해 더욱 촉진되고 인터류킨-6에 의해 억제됨을 확인하였다(Suh YG, et al., 2012). 임상실험 결과에서도, 간경변증 환자에게 자가골수세포 주입 후에 혈청 인터류킨-10이 현저하게 상승하여 동물실험 및 in vitro 실험결과와 부합되는 결론을 얻을 수 있었다(Suh YG, et al., 2012). 뿐만 아니라 사염화탄소 유도 간섬유화 마우스 모델에서 colony stimulatory factor-1(CSF-1) 유도 골수 대식세포 주입 후에 인터류킨-10이 상승됨이 보고되었다(Thomas JA, 2011).
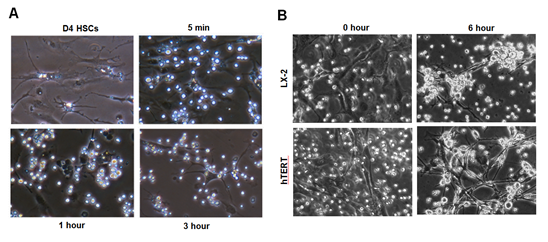
그림 5. 마우스와 인간 간성상세포와 골수세포들 모두에서 상호작용이 관찰됨.
5. 고찰
본 연구결과를 정리하면 그림 6과 같이 주입된 특정 골수세포군들(CD11b+Gr1highF4/80- 세포와 CD11b+Gr1+F4/80+ 세포)이 간내로 이동하여 간성상세포와 상호작용을 통해 항염증 및 항섬유화 기능을 가지는 인터류킨-10을 빠르게 분비하고 또한 간내 염증을 억제하는 Treg의 분포도 증가시켜 결국 항섬유화 기능을 가진다는 것을 증명하였다. 그러나 본 연구에서는 골수세포주입 후 24시간째에 일어나는 현상들에 대해서만 연구가 되어졌을 뿐 어떻게 골수세포들이 활성화된 간성상세포로 이동을 하는 것인지 또한 24시간 후에 일어날 수 있는 상황들에 대해서는 현재까지 알려진 바 없다.
최근 골수세포를 이용한 자가면역세포 주입 치료는 그 기전이 아직까지 명확하지 않으나, 간섬유화 및 간암 모델을 이용한 마우스 모델과 환자들에서도 유용한 효과가 계속해서 입증되고 있다. 그럼에도 불구하고 간 질환 동물모델에서 특히 대식세포의 아형(subtype)에 따른 각기 다른 역할이 제시되고 있다. 예를 들어 CSF-1에 의하여 분화된 골수세포유래 대식세포를 주입하였을 때 간섬유화의 현저한 감소가 보고되었는데, 이것은 주입된 골수세포들이 matrix metalloproteinase(MMP)-9와 MMP-13을 분비함으로써 이루어진 결과이다(Thomas JA, et al., 2011). 반대로, CD11b+F4/80+Gr1+ 대식세포는 TGF-β를 분비함으로써 간섬유화와 대장암 발달을 촉진한다는 보고가 있었다(Karlmark KR, et al., 2009, Schiechl, et al., 2011). 이렇게 서로 상반된 보고들처럼, 골수에서 유래한 다양한 면역세포들은 여러 장기 손상에 대하여 각기 다른 기능을 취하게 되므로, 자가골수세포들의 기능 및 형태학적 분류가 각 장기별 및 질환별로 필요한 실정이다. 따라서 자가골수세포들에 대한 추가 연구를 실시하여 실제 임상에 적용하여 사용할 수 있는 구체적 패러다임이 구축되어야 한다.
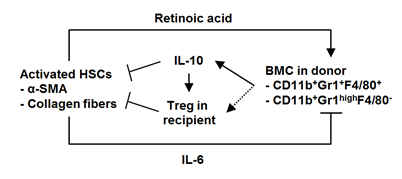
그림 6. 자가골수세포의 항섬유화 기전도
참고문헌
1. Sakaida I, Terai S, Yamamoto N, Aoyama K, Ishikawa T, Nishina H, Okita K. Transplantation of
bone marrow cells reduces CCl4-induced liver fibrosis in mice. HEPATOLOGY 2004;40:1304-1311.
2. Kuo TK, Hung SP, Chuang CH, et al. Stem cell therapy for liver disease: Parameters overning the
success of using bone marrow mesenchymal stem cells. Gastroenterology 2008;134:2111–
2121.e1.
3. Park CH1, Bae SH, Kim HY, Kim JK, Jung ES, Chun HJ, Song MJ, Lee SE, Cho SG, Lee JW, Choi
JY, Yoon SK, Han NI, Lee YS. A pilot study of autologous CD34-depleted bone marrow
mononuclear cell transplantation via the hepatic artery in five patients with liver failure.
Cytotherapy 2013;15(12):1571-1579.
4. Spahr L, Chalandon Y, Terraz S, Kindler V, Rubbia-Brandt L, Frossard JL, Breguet R, Lanthier N,
Farina A, Passweg J, Becker CD, Hadengue A. Autologous bone marrow mononuclear cell
transplantation in patients with decompensated alcoholic liver disease: a randomized controlled
trial. PLoS One. 2013;8(1):e53719.
5. Amin MA, Sabry D, Rashed LA, Aref WM, el-Ghobary MA, Farhan MS, Fouad HA, Youssef YA.
Short-term evaluation of autologous transplantation of bone marrow-derived mesenchymal stem
cells in patients with cirrhosis: Egyptian study. Clin Transplant. 2013 Jul-Aug;27(4):607-612.
6. Hernandez-Gea V, Friedman SL. Pathogenesis of liver fibrosis. Annu Rev Pathol 2011;6:425-456.
7. Friedman SL. Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver.
Physiol. Rev. 2008; 88: 125–172.
8. Thompson K, Maltby J, Fallowfield J, McAulay M, Millward-Sadler H, Sheron N. Interleukin-10
expression and function in experimental murine liver inflammation and fibrosis. HEPATOLOGY
1998;28:1597-1606.
9. Radaeva S, Wang L, Radaev S, Jeong WI, Park O, Gao B. Retinoic acid signaling sensitizes
hepatic stellate cells to NK cell killing via upregulation of NK cell activating ligand RAE1. Am J
Physiol Gastrointest Liver Physiol 2007;293:G809-G816.
10. Winau F, Hegasy G, Weiskirchen R, Weber S, Cassan C, Sieling PA, et al. Ito cells are liver-
resident antigen-presenting cells for activating T cell responses. Immunity 2007;26:117-129.
11. Radaeva S, Sun R, Jaruga B, Nguyen VT, Tian Z, Gao B. Natural killer cells ameliorate liver
fibrosis by killing activated stellate cells in NKG2D-dependent and tumor necrosis factor-related
apoptosis-inducing ligand-dependent manners. Gastroenterology 2006;130:435-452.
12. Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS,
Greenberger JS, Goff JP. Bone marrow as a potential source of hepatic oval cells. Science.
1999 May 14;284(5417):1168-70.
13. Terai S, Ishikawa T, Omori K, Aoyama K, Marumoto Y, Urata Y, Yokoyama Y, Uchida K,
Yamasaki T, Fujii Y, Okita K, Sakaida I. Improved liver function in patients with liver cirrhosis
after autologous bone marrow cell infusion therapy. Stem Cells. 2006 Oct;24(10):2292-8.
14. 12. Biermann H, Pietz B, Dreier R, Schmid KW, Sorg C, Sunderkotter C. Murine leukocytes with
ring-shaped nuclei include granulocytes, monocytes, and their precursors. J Leukoc Biol
1999;65:217-231.
15. Gabrilovich DI, Nagaraj S. Myeloid-derived suppressor cells as regulators of the immune
system. Nat Rev Immunol. 2009 Mar;9(3):162-74
16. Youn JI, Gabrilovich D. The biology of myeloid-derived suppressor cells: The blessing and the
curse of morphological and functional heterogeneity. Eur J Immunol. 2010;40:2969–2975.
17. Ostrand-Rosenberg S. Myeloid-derived suppressor cells: more mechanisms for inhibiting
antitumor immunity. Cancer Immunol Immunother 2010;59: 1593–1600.
18. Ichikawa S, Mucida D, Tyznik AJ, Kronenberg M, Cheroutre H. Hepatic stellate cells function as
regulatory bystanders. J Immunol 2011; 186:5549-5555.
19. Suh YG, Kim JK, Byun JS, Yi HS, Lee YS, Eun HS, Kim SY, Han KH, Lee KS, Duester G, Friedman
SL, Jeong WI. CD11b(+) Gr1(+) bone marrow cells ameliorate liver fibrosis by producing
interleukin-10 in mice. Hepatology. 2012 Nov;56(5):1902-1912.
20. Thomas JA, Pope C, Wojtacha D et al. Macrophage therapy for murine liver fibrosis recruits
host effector cells improving fibrosis, regeneration, and function. Hepatology 2011; 53:
2003–2015.
21. Karlmark KR, Weiskirchen R, Zimmermann HW, Gassler N, Ginhoux F, Weber C, et al. Hepatic
recruitment of the inflammatory Gr1þ monocyte subset upon liver injury promotes hepatic
fibrosis. HEPATOLOGY 2009;50:261-274.
22. Schiechl G, Bauer B, Fuss I, Lang SA, Moser C, Ruemmele P, et al. Tumor development in
murine ulcerative colitis depends on MyD88 signaling of colonic F4/80+CD11b(high)Gr1(low)
macrophages. J Clin Invest 2011;121:1692-1708.





