2. 초저온 전자 현미경을 통한 고해상도 구조 연구
초저온 전자현미경을 이용한 단백질의 구조 분석은 70년대부터 꾸준하게 진행되어 왔다. 단백질 분자에 대한 본격적인 연구는 80년대 Single-molecule cryo electron microscopy가 도입되면서 이루어 졌는데, 단백질을 얇은 ice (얼음)에 가두어서 전자현미경을 이용하여 2D projection 이미지를 획득하여 이로부터 3D 구조를 규명하는 것이다. 단백질의 2D projection을 얻는 과정에서 이들 단백질들의 얼음 안에서의 방향성 (orientation) 정보를 잃어버리게 되는데, 이러한 방향성 정보는 다양한 방향의 단백질의 2D projection 이미지를 얻어 계산을 통해서 얻을 수 있다. 하지만, 이러한 방향성 정보의 부정확성, 전자에 의한 단백질의 radiation damage, detector의 비효율성으로 인해 낮은 해상도의 단백질 구조 규명만 가능했었고, 이로 인해 단백질 구조연구에 중심에 서지 못하고 대부부분 X-선 결정학적 방법론으로 접근이 어려운 리보좀등과 같은 크기가 큰 수프라몰레귤(Supramolecule)의 낮은 해상도 구조를 연구해 왔다. 하지만, 최근 전자현미경의 새로운 발달로 인해서 원자수준의 구조를 규명할 수 있는 단계에 들어 셨다. 그 예로, 초저온 전자현미경을 이용하여 단백질의 3차원 구조를 고해상도로 규명하여 X-선 결정학적 방법론에 의해서만 가능하였던 아미노산의 잔기의 전자 밀도까지 볼 수 있는 수준에 이르렀다 (그림 1).
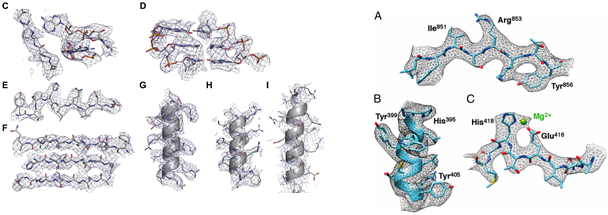
그림 1. 초저온 전자현미경을 이용한 고해상도 리보좀(좌: Bai et al., eLife2013) 및
GALALCTOSIDASE (우: Bartesaghi et al., PNAS 2014)
이러한 발달은 그림 2와 같은 초저온 전자현미경을 구조생물학 연구에 있어서 각 단계에 이용한 새로운 기기와 기술의 도입으로 가능해졌다.
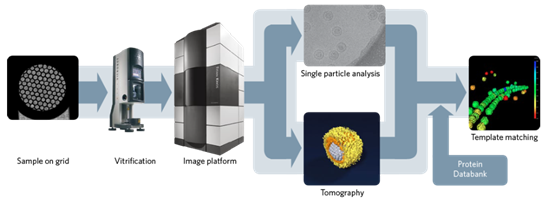
그림 2 전자현미경을 이용한 Structural biology work flow (www.fei.com)
1). New Microscopy and New detector system:
전자 현미경을 통해 고해상도의 이미지를 얻는데 지금까지 문제가 되었던 것은 이미지를 얻는 과정에서 단백질 시료가 전자빔에 의해 움직이는 것과, detector system의 낮은 수율때문이었다. 최근 이러한 문제점들을 극복한 전자를 직접 detect할 수 있는 direct detector가 개발 되었다. 이러한 direct detector를 이용하여 movie mode로 이미지를 얻을 수 있는데, 즉 1초간 이미지를 얻는 동안 40-60개의 frame의 이미지를 획득하여 각 이미지를 computational align을 하게 되면 전자빔에 의해 움직이는 샘플을 align하여 고해상도 이미지를 얻을 수 있게 되었다.
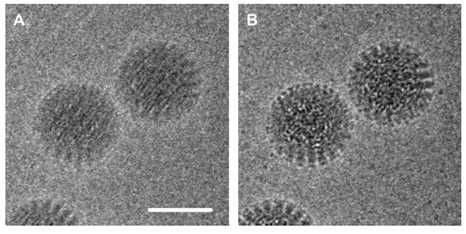
그림 3. Movie mode 와 alignment 를 통한 고해상도 이미지 획득
(좌: without alignment, 우: with alignment) (Grigorieff, eLIFE 2013)
2). Automated Single Particles Acquisition Software (EPU):
Single-particle cryoEM (단분자 초저온 전자현미경)을 이용하여 단백질의 구조를 규명하기 위해서는 적게는 몇만개 혹은 백만개 이상의 단분자의 이미지를 획득하여야 한다. 지금까지는 이러한 대량의 이미지 획득은 많은 시간이 소모되는 작업이었다. 하지만, 최근 FEI에서 Automated Single Particles Acquisition Software (EPU: “E pluribus Unum”, Latin pharase for “out of many, one”) 이나 Jeol 의 JEOL Automated Data Acquisition System (JADAS) software 의 도입으로 사람의 작업을 최소화하여 대량의 이미지를 획득하는 방법이 개발 되었다. EPU를 이용할 경우 하루 약 250,000개의 단분자 이미지를 획득이 가능하여 High-throughput으로 데이터 획득이 가능해 졌다.
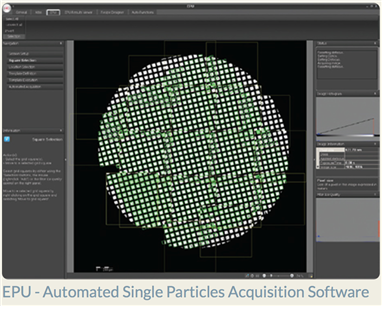
그림 4. EPU (www.fei.com)
3) 새로운 Data processing Algorithm 과 Software 의 개발:
새로운 기기와 새로운 Detector 의 발달과 함께, 이미지 데이터를 처리하는 새로운 Algorithm과 Software가 개발되고 있어, 단분자 전자현미경을 이용한 고해상도 단백질 구조의 분석이 가능해 지고 있다. 하지만, 현재는 이러한 Software의 개발이 초기 단계에 있어, 많은 이용자들이 용이하기 이용하기 위한 노력이 필요한 것으로 예상된다.
3. Perspectives
최근 새로운 전자 현미경 기기와 detection 시스템의 발달로, 단분자 전자현미경을 이용하여 원자수준의 해상도 구조분석이 가능해 졌다. 하지만, 아직까지도 이러한 구조 분석법을 많은 연구자들이 이용하기에는 몇가지 한계점이 있다. 첫째, 현재 고해상도 구조 분석이 가능한 기기는 약 50억정도로 매우 고가 이며, 유지비기 5억/1년정도의 비용이 들어, 개인연구자들이 보유할 수 없는 경우가 대부분이다. 지금도 미국, 유렵 몇 곳에서 구조 연구 센터에서 이러한 장비를 보유하고, 연구자들이 EM beamtime을 신청하여 구조연구를 진행하고 있는 상태이다. 이러한 고가의 EM 장비는, X-선 결정학에 이용되는 synchrotron facility와 비슷한 개념으로 운영되는 것이 바람직하다고 본다. 즉 거대 연구 센타에서 집중적으로 EM 장비를 구입 및 유지를 담당하고, 연구자들이 synchrotron facility를 이용하는 것과 비슷한 형식으로 EM beamtime을 share하는 형식으로 운영되어야 할 것으로 본다. 우리나라에서도 다행이 최근 기초과학지원연구원에서 Titan Krios EM 장비의 도입이 추진되고 있는데, 앞으로의 이러한 고성능 EM장비의 수요를 고려할 때 2-3대의 장비도입이 추가되입이 절실히 필요할 것으로 예상된다.
전자 현미경을 이용한 원자 수준의 해상도로 단백질의 구조를 연구하는 것은, 기존에 단백질의 결정을 획득해야만 했던, X-선 결정학적 방법의 단점을 뛰어넘는 구조생물학에서 매우 중요한 역할을 담당할 것이다. 하지만, 전자 현미경을 이용한 구조연구는 아직도 300KDa 이상의 거대 분자에서만 가능하기 때문에, X-선 결정학은 앞으로 그 크기가 작은 분자에 집중 될 것으로 예상되고, 전자현미경은 결정화하기 힘든 거대분자에 집중할 것으로 예상된다. 전자현미경을 이용한 단백질의 구조 분석은 그 필요한 단백질의 양은 X-선 결정학적 방법론에 필요한 단백질의 양에 비해 매우 적은 양이지만, 매우 높은 quality의 단백질이 필요한 것에서는 X-선 결정학적 방법과 비슷한 기준이 요구된다. 전자현미경을 이용한 고해상도의 단백질 구조가 가능해짐에 따라 앞으로는 점점 더 고순도의 단백질 시료의 획득이 구조 생물학에서 핵심적인 역할을 하게 될 것으로 예상된다.





