진세노사이드 기반 지능형 면역기능 조절 관련 연구동향

울산대학교 의과대학 김헌식
1. 개요
인삼의 대표적인 약리효능에는 항암활성, 면역증진 등이 있으며 상당부분 인삼사포닌(ginsenoside)이란 성분에 기인하는 것으로 밝혀지고 있다 (Berek et al., 2001; Chang et al., 2003; Lee et al., 2004). 인삼 사포닌은 트리테르페노이드 계열의 담마란(dammarane) 골격에 포도당, 아라비노오스, 자일로오스, 람노오스 등이 결합한 비스데스모사이드의 중성 배당체이다. 이들을 column chromatography에 의한 극성 순서에 따라 Ginsenoside Rx라고 명명한다. 현재 약 40여종의 인삼사포닌 성분들이 규명되었으며 화학적 구조식에 따라 크게 protopanaxadiol (PPD)계와 protopanaxatriol (PPT)계로 나눌 수 있다. PPD계 주요 사포닌들로는 Rb1, Rb2, Rb3, Rc, Rd, Rg3, Rh2 과 aglycone PD등이 있고 PPT계 주요 사포닌들로는 Rg1, Rg2, F1, Rh1과 aglycone PT등이 있다 (그림 1).
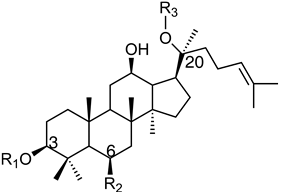
그림 1. 인삼사포닌 (ginsenosides)의 화학구조. glc = glucosyl (C6H11O6-);
rha = rhamnosyl (C6H11O5-);ara = arabinosyl (C5H9O5-);p=pyran;f=furan.(Yu et al., 2007)
인삼사포닌은 또 인삼 내 함량에 따라 major 사포닌과 minor 사포닌 두 가지로 분류할 수 있다. 그중 major 사포닌인 Rb1, Rb2, Rc, Rd, Re 및 Rg1은 총 사포닌의 90%이상을 차지하고 특히 PPD 타입의 4가지 major 사포닌인 Rb1, Rb2, Rc와 Rd가 총 사포닌의 50-70%를 차지하고 있다. 이러한 major 사포닌은 고분자 구성성분과 연결되어 있어 인체에 섭취 후 체내에 잘 흡수가 되지 못하지만 사람의 장내에 서식하는 특유의 미생물에 의해 가수분해 되어 여러 개 당이 떨어져 minor 사포닌 형태인 Rg3, Rh1, Rh2 와 compound K로 전환되면 쉽게 흡수가 된다 (Cui et al., 2013). 뿐만 아니라 이러한 minor 사포닌은 major 사포닌에 비해 항암활성, 면역증가, 혈액개선, 치매방지 등에서 탁월한 약효를 나타낸다는 것이 밝혀지고 있다 (Kang et al., 2012).
인삼 및 인삼류 가공물의 전 세계적 소비량과 판매량(세계 3조 매출/연)에 비하면 인삼사포닌 관련 연구는 상대적으로 저조한 실정이며 이는 상당부분 개별 인삼사포닌의 충분한 획득이 어렵기 때문이다. 자연계에 천연으로 존재하는 major 사포닌들은 상대적으로 그 연구가 어느 정도 진척되어 있지만 minor 사포닌들은 확보가 어려워 약리효과에 대한 연구가 상대적으로 미비한 실정이다. 최근 미생물 효소 및 재조합 효소를 이용한 전환기법의 개발, 재조합 인삼발효 미생물 이용 등 합성생물학적 방법에 의한 minor 사포닌의 확보가 비교적 용이해지고 있다 (Cui et al., 2013). 따라서 minor 사포닌을 포함하여 개별 인삼사포닌에 대한 체계적인 약리효과 연구가 가능해 졌으며 이에 따라 주요 약리효과인 면역증진, 항암활성 효과에 대한 연구가 많은 관심을 받고 있다. 본 보고서에서는 인삼사포닌(ginsenoside)의 대표적인 면역기능 조절 효과를 중심으로 개별 ginsenoside의 활성 규명 및 이를 통한 선택적 면역기능 조절의 필요성 등에 대해 고찰해 보고자 한다.
2. 인삼사포닌 (ginsenoside)에 의한 면역기능 조절
면역력이란 내부의 암세포를 비롯하여 외부로부터 침입한 세균과 바이러스 등에 대한 인체 방어시스템의 역할을 한다. 따라서 면역력을 키우는 것은 건강을 지키는 기본이며 인삼이 인체의 면역력을 향상시킨다는 것은 이미 여러 차례 과학적으로 입증된 사실이다. 덴마크 국립병원 아르잘란 카라즈미 박사팀은 인삼이 인간의 면역기능을 개선한다는 실험 결과를 2004년 10월 발표하였다. 카라즈미 박사는 인삼이 신체의 면역기능을 향상시켜 염증을 빨리 없앨 뿐 아니라 감기에도 효과가 있다고 밝혔다. 2001년 일본에서도 비슷한 연구 결과가 발표었는데 일본 가네코 박사는 45~90세 외래환자 41명을 대상으로 감기와 홍삼가루의 섭취 관계를 조사하였으며 홍삼섭취가 감기예방에 효과가 있음을 관찰하였다.
국내의 경우 최근 면역과 관련된 고려홍삼의 연구가 각광을 받고 있으며 사포닌 및 다당류의 면역조절작용에 관한 연구가 많이 진행되었다. 사포닌 및 다당류는 T림프구의 세포증식을 촉진하며, 세포독성 림프구들의 암세포 파괴력을 증가시킨다고 보고되었다. 또한 고려홍삼은 특히 면역기능을 강화하고 NK세포의 활성을 증가시키며 암세포 전이의 억제는 이에 기인한다고 발표되었다. 이 밖에 고려홍삼이 염증인자 (cytokine)의 생성 및 억제에 관여한다는 많은 연구결과가 발표되었다. 그 외에도 많은 연구들을 통해 인삼추출물이 면역기능 조절에 효과가 탁월함이 발표되었다 (그림 2).
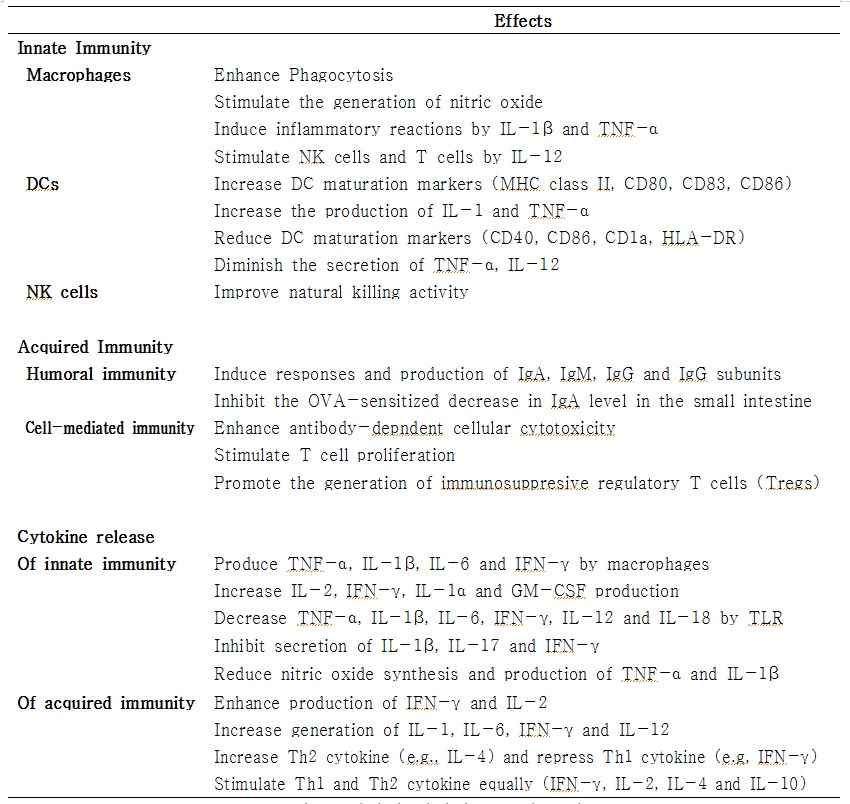
그림 2. 인삼의 면역기능 조절 요약(Kang and Min, 2012)
하지만 인삼의 진세노사이드 같은 특정 성분과 면역 활성과의 구체적인 인과관계는 체계적인 연구가 부족하여 아직까지 걸음마 단계로 볼 수 있다. 특히 한국인삼 및 홍삼에 풍부한 minor 사포닌을 중심으로 인삼사포닌의 면역활성 영향에 대한 체계적인 연구는 매우 미흡한 편이다.
Major 인삼사포닌 중에서는 Rg1이 주로 면역력 증진작용과 연관이 있는 것으로 보고되었다 (Kenarova et al., 1990; Lee and Han, 2006). 특히 minor 인삼사포닌 성분인 Rg3가 주목을 받고 있는데 중국 등 일부 국가에서는 이미 폐암과 간암치료제의 신약성분으로 쓰일 만큼 효과가 입증된 성분이다. 항암효과와 함께 암의 전이를 억제하고 혈액순환 촉진과 면역력 증강, 혈당치 저하 등에 효과가 있음이 알려지고 있다. 고려인삼의 경우 0.02% 가량의 극소량만 존재하나, 고려홍삼의 경우에는 % 단위로 존재한다고 알려지고 있다. 하지만 항암효과 및 면역력 증강에 관한 구체적인 작용기전은 알려져 있지 않다 (Chang et al., 2003). 또한 역시 minor 사포닌 성분인 Rh2는 암세포의 중식억제작용이 강하고 동물모델에서 NK cell의 활성을 증가시킬 수 있음이 보고되었다 (Nakata et al., 1998).
3. 인삼사포닌 (ginsenoside)에 의한 NK 세포 대식세포 기능 조절
NK 세포는 암 및 바이러스 감염질환을 중심으로 다양한 인체 질환의 발병에 중추적인 역할을 하며 NK 세포 기능이상은 상기 질환의 임상예후와 밀접한 관련성을 가지는 것으로 보고되었다. NK 세포는 다른 면역세포와 달리 암 세포 및 바이러스 감염세포를 즉각적으로 감지하여 바로 제거할 수 있는데 이것은 NK 세포표면에 존재하는 다양한 면역수용체 (Immune receptor)를 통해 질환세포와 정상세포를 구분할 수 있음에 기인한다 (Lanier, 2005; Long 2013). 또한 NK 세포는 IFN-γ나 TNF-α 같은 염증인자(cytokine) 생성을 통해 염증 및 면역반응을 조절 하는데 핵심적인 역할을 한다. 이를 통해 암세포 및 바이러스 감염 세포 제거뿐 아니라 골수이식, 태아의 착상 및 생식조절, 염증질환, 자가면역 질환 등 각종 난치성질환의 발병에도 중요한 역할을 함이 규명되고 있다 (Vivier et al, 2008). NK 세포는 최근 항암 면역치료제 개발 측면에서 주목을 받고 있는데 이는 NK 세포가 암세포의 발생, 증식, 전이를 억제할 뿐만 아니라 암의 재발에 중요한 암줄기세포를 제거할 수 있음에 기인 한다 (Castriconi et al., 2009).
현재까지 인삼의 다당체나 추출물에 의한 NK세포의 활성 증진 보고는 많이 있었으나 특정 ginsenoside에 의한 체계적인 활성 조절 연구는 매우 부족한 실정이다. Major ginsenoside인 Rg1과 minor ginsenoside인 Rh2가 동물모델에서 NK cell의 활성을 증가시킬 수 있음이 보고된 정도이다 (Kenarova et al., 1990; Nakata et al., 1998). 그러나 이들 연구는 동물에 직접 투여하거나 비장 (spleen)에 처치 후 얻어진 결과로 직접적인 NK세포 활성 증진과의 인과관계가 모호한 실정이다. 따라서 좀 더 체계적인 연구로 개별 ginsenoside와 NK 세포 활성과의 상관관계가 규명되면 NK세포관련 다양한 질환 치료에 응용이 가능할 것으로 기대된다. 특히 ginsenoside는 다른 식물에서 발견되는 사포닌과 달리 대량으로 투여하였을 경우에도 용혈독성이 관찰되지 않아 안전성이 큰 장점이 있다.
대식세포는 식균작용이 있기 때문에 자연면역에서 중요한 기능을 나타낸다. 이들은 미생물, 항원, 죽은 조직, 적혈구 등을 식균작용으로 파괴할 수 있다. 대식세포는 대표적인 분비세포로서, 약 50여 가지 이상의 활성 및 염증 물질을 분비한다. 이들 대식세포 분비물질들은 염증반응의 조절에서 중요한 역할을 하는 것으로 알려져 있다. 예를 들어 다양한 단백질 분해효소, 지질 대사물질, cytokine등을 분비하여 염증반응의 진행과 유지에서 핵심적인 역할을 한다. 대식세포는 또한 염증반응으로 인한 조직의 파괴를 막아주는 다양한 혈장 단백질도 분비하며, 혈액응고인자나 보체 단백질 등도 분비한다. 하지만 대식세포의 과도한 활성화나 기능이상은 다양한 질환의 발병과 깊은 연관이 있으며 대표적으로 류마티스 관절염 같은 자가면역질환, 만성 위염, 위궤양, 간염 같은 만성염증 질환의 발병에 중요한 역할을 한다. 최근에는 암이나 당뇨병 등의 유발에도 관여함이 알려지고 있어 대식세포의 적절한 활성조절이 중요하다. 현재까지 몇몇 ginsenoside가 대식세포의 염증반응을 조절할 수 있음이 알려지고 있는데 대표적으로 C-K, Rb1, Rc, Re, Rg1, Rg5 등이 대식세포의 염증반응 및 류마티스 관절염, 아토피 같은 다양한 염증질환을 경감시킴이 보고되었다 (Kang and Min, 2012).
4. 고찰
그동안 인삼 관련 연구의 국내 및 국외 저변은 넓은 편이었으나 지속적, 체계적인 연구가 미흡하였다. 특히 인삼 추출물 중심으로 연구가 주로 진행되어 기존에 보고된 다양한 면역조절 기능과 개별 ginsenoside 성분과의 연계성이 매우 부족한 실정이었다. 또한 활성이 확인된 ginsenoside 성분의 세포 및 면역학적 기전연구 미흡으로 연구결과의 신뢰성이 크게 담보되지 못하였다. 이는 개별 ginsenoside 시료를 직접 추출하는 것에 주로 의존하여 충분한 시료의 확보에 어려움이 큰 것에 상당 부분 기인한다. 실제로 ginsenoside 연구는 major 성분 (Rg1, Re, Rb1, Rb2, Rc, Rd 등) 중심 약리활성 연구에 치중되어 있었고 아직까지 minor 성분 (Rg3, F1, C-K, Rh1, Rh2 등)에 대한 연구가 크게 미흡한 실정이다.
특히 인삼추출물의 경우 면역세포, 자극조건, 질환 model 별로 상이한 면역 조절 기능을 가짐이 보고되었다. 이는 인삼추출물 내에 다양한 종류의 ginsenoside (PPD vs. PPT, major vs minor)가 혼재되어 나타나는 복합적인 면역기능 조절 효과에 기인한 것으로 사료된다. 따라서 개별 ginsenoside에 대한 체계적인 면역기능 조절 규명이 필요한 실정이다. 이를 통해 세포별, 질환별로 특정 ginsenoside를 활용한 맞춤 면역기능 조절이 가능할 것이다. 이에 대한 선결 조건으로 표준화된 개별 ginsenoside의 대량 확보가 시급한데 최근 급속히 발전하고 있는 합성생물학적 대량 생산방법을 통해 해결 가능할 것으로 예측된다. 이를 통해 개별 ginsenoside에 의한 다양한 면역세포 (NK세포, 대식세포 등)의 활성조절 기능이 체계적으로 규명된다면 최종적으로 ginsenoside 기반 지능형 면역기능 조절 및 관련 질환치료에 새로운 전기를 가져올 것으로 전망된다.
참고문헌
1. Berek, L., Szabo, D., Petri, I.B., Shoyama, Y., Lin, Y.H., Molnar, J. Effects of naturally occuring glucosides, solasodine glucosides, ginsenosides and parishin derivatives on multidrug resistance of lymphoma cells and leucocyte functions. In Vivo. 2001, 15, 151-156.
2. Biron CA, Byron KS, Sullivan JL. Severe herpesvirus infections in an adolescent without natural killer cells. N Engl J Med. 1989, 320, 1731-1735.
3. Bryceson, Y.T., March, M.E., Ljunggren, H.-G., and Long, E.O. Activation, coactivation, and costimulation of resting human natural killer cells, Immunol. Rev., 2006, 214, 73-91.
4. Bryceson, Y.T. and Long, E.O. Line of attack: NK cell specificity and integration of signals, Curr. Opin. Immunol., 2008, 20, 344-352.
5. Castriconi, R., Daga, A., Dondero, A., Zona, G., Poliani, P.L., Melotti, A., Griffero, F., Marubbi, D., Spaziante, R., Bellora, F., Moretta, L., Moretta, A., Corte, G., Bottino, C. NK cells recognize and kill human glioblastoma cells with stem cell-like properties. J Immunol. 2009, 182, 3530-3539.
6. Chang, Y.S., Seo, E.K., Gyllenhaal, C., Block, K.I. Panax ginseng: A role in cancer therapy? Integr Cancer Ther. 2003, 2, 13-33.
7. Cui, C.H., Liu, Q.M., Kim, J.K., Sung, B.H., Kim, S.G., Kim, S.C., Im, W.T. Identification and Characterization of Mucilaginibacter sp. QM49 β-Glucosidase and its use in Producing the Pharmaceutically Active Minor Ginsenosides, Rh1(S) and Rg2(S). Appl Environ Microbiol. 2013, [Epub ahead of print]
8. Hasegawa, H., Suzuki, R., Nagaoka, T., Tezuka, Y., Kadota, S., Saiki, I. Prevention of growth and metastasis of murine melanoma through enhanced natural-killer cytotoxicity by fatty acid-conjugate of protopanaxatriol. Biol Pharm Bull. 2002, 25, 861-866.
9. Holmes, T.D., El-Sherbiny, Y.M., Davison, A., Clough, S.L., Blair, G.E., and Cook, G.P. A human NK cell activation/inhibition threshold allows small changes in the target cell surface phenotype to dramatically alter susceptibility to NK cells. J. Immunol., 2011, 186, 1538-1545.
10. Kang, K.A, Kang, J.H., Yang, M.P. Ginseng total saponin enhances the phagocytic capacity of canine peripheral blood phagocytes in vitro. Am J Chin Med. 2008, 36, 329-341.
11. Kang, S., Min, H. Ginseng, the ’Immune boost’: the effects of panax ginseng on immune system. J Ginseng Res. 2012. 36, 354-368.
12. Kärre, K., Ljunggren, H.G., Piontek, G., and Kiessling, R. Selective rejection of H-2-deficient lymphoma variants suggests alternative immune defence strategy. Nature, 1986, 319, 675-678.
13. Kenarova, B., Neychev, H., Hadjiivanova, C., Petkov, V.D. Immunomodulating activity of ginsenoside Rg1 from Panax ginseng. Jpn J Pharmacol. 1990, 54, 447-454.
14. Kim, H.S., Das, A., Gross, C.C., Bryceson, Y.T., and Long, E.O. Synergistic signals for natural cytotoxicity are required to overcome inhibition by c-Cbl ubiquitin ligase, Immunity, 2010, 32, 175-186.
15. Kim HS, Long EO. Complementary phosphorylation sites in the adaptor protein SLP-76 promote synergistic activation of natural killer cells. Sci Signal. 2012, 5, ra49.
16. Lanier, L.L. NK cell recognition, Annu. Rev. Immunol., 2005, 23, 225-274.
17. Lanier, L.L. Up on the tightrope: natural killer cell activation and inhibition. Nat. Immunol., 2008, 9, 495-502.
18. Lee, E.J., Ko, E., Lee, J., Rho, S., Ko, S., Shin, M.K., Min, B.I., Hong, M.C., Kim, S.Y., Bae, H. Ginsenoside Rg1 enhances CD4(+) T-cell activities and modulates Th1/Th2 differentiation. Int Immunopharmacol. 2004, 4, 235-244.
19. Lee, J.H., Han, Y. Ginsenoside Rg1 helps mice resist to disseminated candidiasis by Th1 type differentiation of CD4+ T cell. Int Immunopharmacol. 2006, 6, 1424-1430.
20. Long EO, Kim HS, Liu D, Peterson ME, Rajagopalan S. Controlling natural killer cell responses: integration of signals for activation and inhibition. Annu Rev Immunol. 2013, 31, 227-258.
21. Nakata, H., Kikuchi, Y., Tode, T., Hirata, J., Kita, T., Ishii, K., Kudoh, K., Nagata, I., Shinomiya, N. Inhibitory effects of ginsenoside Rh2 on tumor growth in nude mice bearing human ovarian cancer cells. Jpn J Cancer Res. 1998, 89, 733-740.
22. Sung, H., Kang, S.M., Lee, M.S., Kim, T.G., Cho, Y.K. Korean red ginseng slows depletion of CD4 T cells in human immunodeficiency virus type1-infected patients. Clin Diagn Lab Immunol. 2005, 12, 497-501.
23. Terme, M., Ullrich, E., Delahaye, N.F., Chaput, N., and Zitvogel., L. Natural killer cell-directed therapies: moving from unexpected results to successful strategies, Nat. Immunol., 2008, 9, 486-494.
24. Vivier, E., Tomasello, E., Baratin, M., Walzer, T., and Ugolini, S. Functions of natural killer cells, Nat. Immunol., 2008, 9, 503-510.
25. Vivier, E., Raulet, D.H., Moretta, A., Caligiuri, M.A., Zitvogel, L., Lanier, L.L., Yokoyama, W.M., and Ugolini, S. Innate or adaptive immunity? The example of natural killer cells. Science 2011, 331, 44-49.





