생체방어펩타이드의 대량생산 및 실용화에 대한 최근 연구동향

경상대학교 조주현 교수
1. 개요
항생제 내성균의 급격한 증가로 인해 항생제 개발의 필요성이 증대되는데도 불구하고 그동안 신규 항생제 개발은 더디게 이루어져 왔다. 지난 40여 년간 새로 출시된 항생제는 oxazolidinone계열에 속하는 linezolid(자이복스, Pfizer), cyclic lipopeptide계의 daptomycin(큐비신, Cubist pharmaceutical) 등 4종에 불과하다(Song, 2012). 또한 현재 개발이 진행 중인 항생제들도 대부분 기존 항생제와 유사한 작용기작을 가져 지속적인 항생제 내성 문제를 유발할 수밖에 없으며, 비특이적인 항균작용으로 인해 체내 정상세균총(normal flora)을 파괴하여 이차감염을 유발하는 등의 문제를 가진다. 따라서 기존의 항생제와는 다른 작용기작을 가지는 동시에 병원균에만 특이적인 항생작용을 나타낼 수 있는 새로운 패러다임의 감염 치료제의 개발이 절실한 실정이다.
최근 들어 기존 항생제의 문제점을 해결할 수 있는 대안으로 생체방어펩타이드(host defense peptide, HDP)가 주목받고 있다. 생체방어펩타이드는 자연면역체계(innate immune system)의 일원으로 모든 생물체가 가지고 있는 10-50개의 아미노산으로 구성된 작은 크기의 펩타이드로서 생물체가 병원균에 감염되었을 때 1차 방어물질로 작용한다(Zasloff, 2002). 이들은 주로 양전하(+2~+9)를 띠며, 30% 정도의 소수성 아미노산 잔기를 포함하고 있는데, 이러한 특징으로 인해 생체방어펩타이드는 음전하를 띤 세균 세포막과 접촉하게 되면 양친성 α-나선구조(amphipathic α-helix) 혹은 β-병풍구조(β-sheet)를 형성하여 세포막 속으로 끼어 들어가 세포막의 전위를 변화시키거나 세포막 자체에 구멍을 내어 세포막을 파괴함으로써 세균을 죽이는 것으로 알려져 있다. 따라서 생체방어펩타이드는 특정 수용체를 타겟으로하는 기존의 항생제에 비해 내성 유발가능성이 현저히 낮다. 이와 더불어 생체방어펩타이드는 신속한 작용 기전, 기존 항생제 내성균에 작용, 항 내독성(anti-endotoxicity) 등의 특징을 가지고 있어 차세대 항생제로서 개발이 적합하다(Hancock & Sahl, 2006).
실제로 hLF1-11(lactoferricin 유도체), iseganan(protegrin 유도체), omiganan(indolicidin 유도체) 등의 생체방어펩타이드를 항생제 대체물질로 개발하려는 시도가 지난 10년간 꾸준히 있어 왔다(표1). 하지만 대다수의 생체방어펩타이드들은 생리적 염농도(physiological salt concentration)에서 불활성화되며, 혈청과 소화관 내에 존재하는 단백질 분해효소에 의해 빠르게 분해되기 때문에 표적 기관으로의 전달/표적 기관에서의 작용이 어려운 문제점이 있다. 또한 무엇보다도 화학합성(solid-phase chemical synthesis)을 통해 생산할 경우 생산 비용(1g 당 100-600$, Yeung et al., 2011)이 높아져 경제성이 낮아지기 때문에 실제로 제품화된 것은 아직 없는 실정이다. 따라서 생체방어펩타이드의 경제적인 대량 생산법을 확립하기 위하여 많은 연구가 진행되고 있다. 본 논고에서는 생체방어펩타이드의 대량생산 및 실용화에 대한 최근 연구동향을 살펴보고자 한다.
표1. 임상시험 중인 생체방어펩타이드
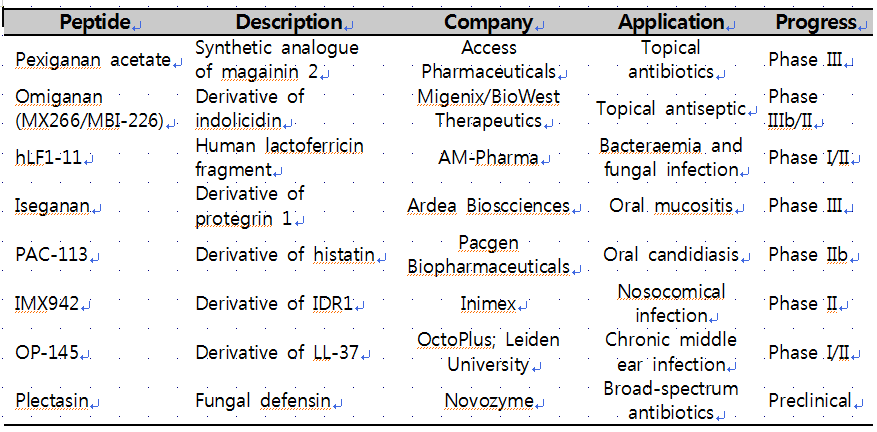
[Modified from Bassetti et al., 2013]
2. 대장균을 이용한 생체방어펩타이드의 생산
현재까지 yeast, insect cell, mammalian cell, plant 등의 다양한 expression host를 사용하는 non-bacterial heterologous expression system이 개발되었지만 생체방어펩타이드의 대량생산을 위한 host organism으로는 Escherichia coli가 가장 널리 사용되고 있다(Yin et al., 2007). 생체방어펩타이드를 E. coli에서 발현시킬 경우 생체방어펩타이드의 특징(anti-bacterial activity, small size, high cationic property)으로 인해 숙주 세포에 대해 세포독성을 나타내거나 단백질 분해효소에 의해 쉽게 분해가 되는 문제점이 있다. 따라서 생체방어펩타이드를 carrier protein과 결합시킨 형태로 발현시킨 뒤, chemical 또는 enzymatic cleavage 과정을 통해 생체방어펩타이드를 얻어내는 fusion expression 전략이 주로 사용되고 있다.
1) Fusion expression
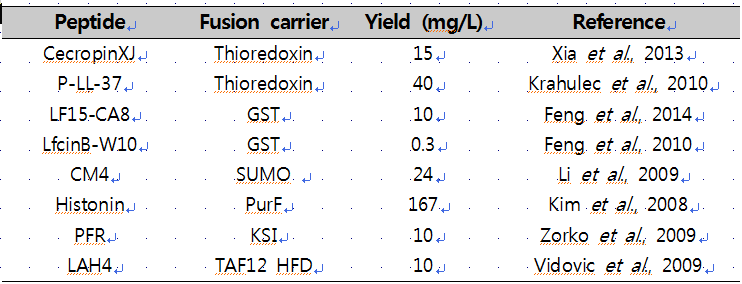
생체방어펩타이드의 fusion expression에 가장 널리 사용되는 carrier protein은 thioredoxin과 glutathione trasferase(GST)이다(표2). 이들은 재조합 단백질의 E. coli cytoplasm에서의 solubility를 증가시켜주는 장점을 가지며, 특히 thioredoxin은 size(11.8 kDa)가 작기 때문에 peptide-to-carrier ratio를 증가시켜 높은 수율을 확보할 수 있다. 최근 들어서는 타겟 단백질의 folding과 solubility를 향상시켜주는 것으로 알려져 있는 small ubiquitin-related modifier(SUMO)도 많이 사용되고 있는데, SUMO 역시 thioredoxin과 마찬가지로 size(11.2 kDa)가 작기 때문에 peptide 수율 측면에서 유리하다. GST는 carrier protein으로서의 기능뿐만 아니라 immobilized glutathione을 이용해 정제가 가능한 affinity tag으로서의 기능을 동시에 가지는 반면, thioredoxin과 SUMO의 경우 fusion protein을 정제하기 위해서는 추가적인 affinity tag이 필요하며 주로 poly histidine tag이 사용된다.
Thioredoxin과 같은 solubility-enhancing carrier뿐만 아니라, 생체방어펩타이드의 fusion expression에는 inclusion body 형성을 유도하는 PurF fragment, ketosteroid isomerase(KSI), TAF12 histone fold domain 등의 aggregation-promoting carrier도 사용된다(표2). 이러한 aggregation-promoting carrier를 이용한 insoluble expression은 soluble expression에 비해 생체방어펩타이드의 독성 완화와 단백질 분해효소에 의한 분해 방지에 유리한 측면이 있으며, centrifugation을 통해 inclusion body를 쉽게 회수할 수 있는 장점이 있다.
표2. Fusion expression을 이용한 생체방어펩타이드의 생산
Fusion protein 형태로 발현된 생체방어펩타이드를 carrier protein으로부터 분리하기 위해서는 chemical 또는 enzymatic cleavage 과정이 필요하다(표3). CNBr, formic acid, hydroxylamine을 이용한 chemical cleavage의 경우 enzymatic cleavage에 비해 상대적으로 비용이 적게 소요되는 반면, 사용되는 chemical이 인체에 유해하며 side-chain modification을 일으킨다는 단점이 있다. Enzymatic cleavage의 경우 전반적인 효율이 chemical cleavage에 비해 떨어진다. Fusion protein의 cleavage에 주로 사용되는 enzyme으로는 enterokinase, factor Xa, thrombin, tobacco etch virus(TEV) protease, SUMO protease가 있는데, 이중 SUMO protease와 TEV protease는 소량의 urea가 존재하는 환경에서도 활성을 유지하며, 비교적 쉽게 대량 생산하여 사용할 수 있는 장점이 있다. 특히 SUMO protease의 경우 특정서열을 인지하는 것이 아니라 SUMO 단백질의 3차 구조를 인지하여 cleavage를 일으키므로 cleavage 정확도가 높으며, cleavage 후 native N-terminal을 가지는 target peptide를 얻을 수 있는 장점이 있다. 반면 enterokinase, factor Xa, thrombin은 가격이 비싸고, pH 변화 및 chaotrope에 취약한 것으로 알려져 있다(Li, 2011).
표3. 자주 사용되는 cleavage reagent

[Modified from Li, 2011]
2) 분리·정제 과정 단순화를 통한 경제성 확보
생체방어펩타이드를 carrier protein과 fusion시켜 생산할 경우 생체방어펩타이드의 host cell에 대한 독성을 억제하고 host cell이 가진 여러 단백질 분해효소로부터 생체방어펩타이드를 보호하여 E. coli에서의 생산을 가능하게 하지만 몇가지의 단점이 존재한다. 먼저 carrier protein으로부터 생체방어펩타이드를 분리하기 위해서는 toxic chemical이나 값비싼 enzyme을 이용한 cleavage가 필요하며 대부분 이러한 cleavage 과정은 낮은 효율을 가진다. 또한 발현된 fusion protein 및 생체방어펩타이드를 분리·정제하기 위해서는 여러 단계의 chromatography 기반의 정제과정이 필요한데 이 역시 경제성을 낮춘다. 따라서 최근 연구들은 생체방어펩타이드의 분리·정제 과정을 줄임으로써 대량생산을 위한 경제성 확보에 초점을 맞추고 있다.
Intein은 RNA의 intron에 대응되는 개념의 protein으로써 protein splicing 과정 중 전구체 단백질로부터 스스로를 잘라내는 능력이 있다. Bioseparation에 사용되는 intein은 thiol reagent 처리, pH 및 온도 변화에 의해 N-terminal 또는 C-terminal cleavage가 일어나는 것이 특징이다. 따라서 fusion expression에 intein을 carrier protein으로 사용할 경우 fusion protein으로부터 enzymatic cleavage 과정 없이 타겟 생체방어펩타이드를 분리할 수 있다. Intein은 fusion protein의 정제를 위해 주로 chitin-binding domain(CBD) 또는 elastin-like peptide(ELP)과 함께 사용 되는데 CBD의 경우 chitin resin을 사용하여 affinity purification이 가능하다. 특히 ELP는 온도에 따라 가역적으로 상변화하는 특징(inverse transition cycling)을 가지고 있기 때문에 intein과 함께 carrier protein으로 사용할 경우 enzymatic cleavage 및 affinity purification 과정 없이 간단히 생체방어펩타이드를 분리·정제할 수 있다(Shen et al., 2010).
Transitionally coupled-two cistron expression system은 carrier protein과 생체방어펩타이드를 직접 fusion시키지 않고 독립적인 상태로 발현시킨다. 이 시스템은 첫 번째 cistron과 두 번째 cistron이 각각 carrier protein(anionic polypeptide)과 생체방어펩타이드를 coding하고 있는데, 첫 번째 cistron의 termination codon이 두 번째 cistron의 start codon과 5'-TAATG-3' 형태로 overlap 되어있어 translation된 anionic polypeptide와 생체방어펩타이드는 시공간적으로 인접하게 위치하여 insoluble complex를 이루게 된다. 따라서 inclusion body의 solubilization 후에 별도의 절단 과정 없이 ion-exchange chromatography를 통해 바로 분리가 가능하다(그림1A, Jang et al., 2009).
생체방어펩타이드의 대량생산을 위한 경제성을 향상시키는 또 다른 방법은 생체방어펩타이드를 분리·정제하지 않고 생체방어펩타이드를 expression한 host cell을 whole cell antibiotics 형태로 직접 사용하는 것이다. Pepsin cleavage site를 가지는 생체방어펩타이드 중합체(multimer)를 E. coli의 표면 단백질인 Lpp-OmpA에 융합시킨 형태로 표면 발현시킨 후 이를 생체 내에 투여하게 되면 위(stomach)에서 pepsin에 의해 생체방어펩타이드가 단량체로 절단되어 분리·정제 과정 없이 생체 내에서 항균활성을 나타내게 된다(그림 1B, Shin et al., 2013).
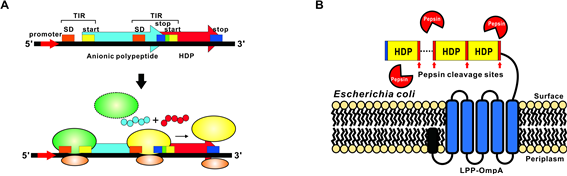
그림1. Translationally coupled two-cistron expression system(A)과 생체방어펩타이드 중합체의 E. coli 표면 발현 시스템(B)
3. 프로바이오틱스를 이용한 생체방어펩타이드 생산
최근 들어 프로바이오틱스가 생체방어펩타이드의 생산·운반을 위한 host cell로서 주목받고 있다(표4). 프로바이오틱스는 bile-resistant한 특징을 가지고 있는 그람양성균으로서 주로 Lactobacillus, Lactococcus, Enterococcus, Streptococcus, Pediococcus, Leuconostoc, Bifidobacterium에 속하는 종이다. 프로바이오틱스는 숙주의 장내에 상주하거나 또는 일시적으로 머무르면서 장벽 강화, 병원체의 억제, 면역 조절 등의 기능을 통해 숙주의 건강에 이로운 역할을 한다(Mandal et al., 2014). 생체방어펩타이드는 일반적으로 낮은 생체 내 안정성으로 인해 투여방법이 매우 제한적이며 특히 경구를 통한 투여는 불가능하지만 프로바이오틱스로 하여금 생체방어펩타이드를 생산·분비하도록 한다면 사람 또는 가축의 장내로 생체방어펩타이드를 안전하게 전달할 수 있을 뿐만 아니라 프로바이오틱스의 본래 기능과 생체방어펩타이드의 항균작용을 동시에 가질 것으로 예상된다(그림2).
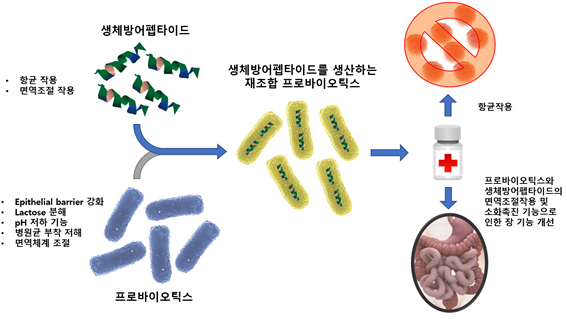
그림2. 생체방어펩타이드를 생산하는 재조합 프로바이오틱스 및 이의 활용
[Modified from Mandal et al., 2014]
한 예로 Volzing et al.은 A3APO와 alyteserin을 생산·분비하는 재조합 L. lactis를 개발하고 병원성 E. coli O157 및 Salmonella typhimurium에 대해 항균력을 가지는 것을 보고하였다(Volzing et al., 2013). 하지만 대부분의 연구가 병원균에 대한 특이성이 낮은 생체방어펩타이드 또는 bacteriocin을 단순히 프로바이오틱스로 하여금 생산·분비하도록 하는데 그치고 있는데, 이는 실제 체내에 사용할 경우 비특이적인 항균작용으로 인해 체내 정상세균총을 파괴하여 이차감염을 유발하는 등의 문제점을 유발할 수 있다. 따라서 이러한 문제를 해결하기 위해서는 먼저 병원균에 특이적으로 작용하는 생체방어펩타이드를 개발하는 것이 선행될 필요가 있다. 또한 생체방어펩타이드의 생산을 조절할 수 있는 발현조절시스템의 개발도 병행되어야 한다.
표4. 프로바이오틱스를 이용한 생체방어펩타이드 및 bacteriocin 생산
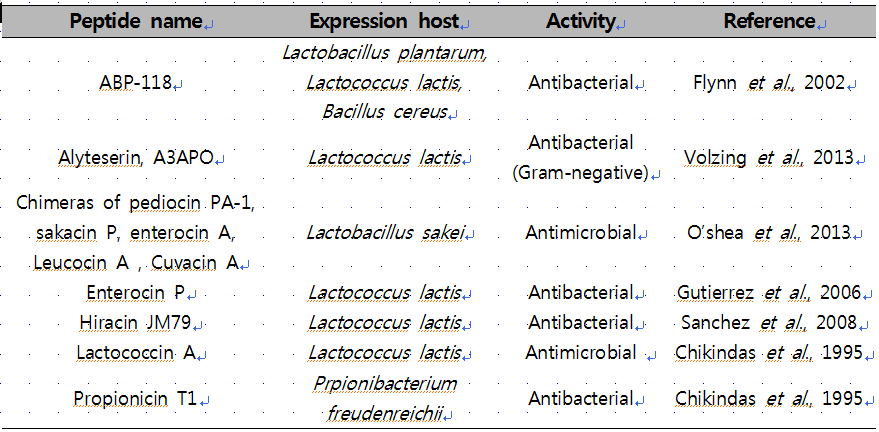
[Modified from Mandal et al., 2014]
4. 고찰
생체방어펩타이드는 고부가 기능성 펩타이드로 차세대 항생제로 주목받고 있지만 높은 생산비용과 낮은 생체내 안정성, 비특이적 작용 등으로 인해 상용화에 많은 제약이 있어 왔다. 그동안 생체방어펩타이드의 실용화를 위한 경제성을 확보하기 위해 다양한 heterologous expression system에 관한 연구가 진행되었지만, 분리·정제 과정에서 소요되는 시간과 비용으로 인해 실용화되기에는 미흡하였다. 하지만 생체방어펩타이드를 생산·분비하는 재조합 프로바이오틱스를 whole cell antibiotics로 이용한다면 분리·정제가 필요없게 되어 생체방어펩타이드의 생산 단가를 획기적으로 낮출 수 있을 뿐 아니라, 생체방어펩타이드를 작용 부위로 직접 전달할 수 있어 기존의 국소치료제로 개발되던 한계에서 벗어나 활용범위를 경구투여 치료제, 건강 보조제, 가축사료 첨가제등에 이르기까지 크게 넓혀줄 것으로 기대된다.
인용문헌
1. Bassetti M et al. (2013) New antibiotics for bad bugs: where are we?. Ann Clin Microbiol Antimicrob 28, doi:10.1186/1476-0711-12-22.
2. Chikindas ML et al. (1995) Expression of lactococcin A and pediocin PA-1 in heterologous hosts. Lett Appl Microbiol 21, 183-189.
3. Feng X et al. (2014) Design and high-level expression of a hybrid antimicrobial peptide LF15-CA8 in Escherichia coli. J Ind Microbiol Biotechnol 41, 527-534.
4. Feng X et al. (2010) Expression and purification of an antimicrobial Peptide, bovine lactoferricin derivative LfcinB-w10 in Escherichia coli. Curr Microbiol 60, 179-184.
5. Fynn S et al. (2002) Characterization of the genetic locus responsible for the production by the probiotic bacterium Lactobacillus salivarius subsp. salivarius UCC118. Microbiology 148, 973-984.





